
2021-07-14 15:02:56来源:新浪医药浏览量:642
导读:从Nature预测的前列腺癌药物市场看,整体前列腺癌药物市场体量会增大近2倍,将在2029年达到300亿美元。
前列腺癌是一种男性雄激素依赖的肿瘤,转移性前列腺癌患者常用药物去势治疗(ADT),最初应答率能达80-90%,但几乎所有患者最终都在去势治疗后进展为转移性去势抵抗性前列腺癌(mCRPC),这类患者5年生存率仅为30%。
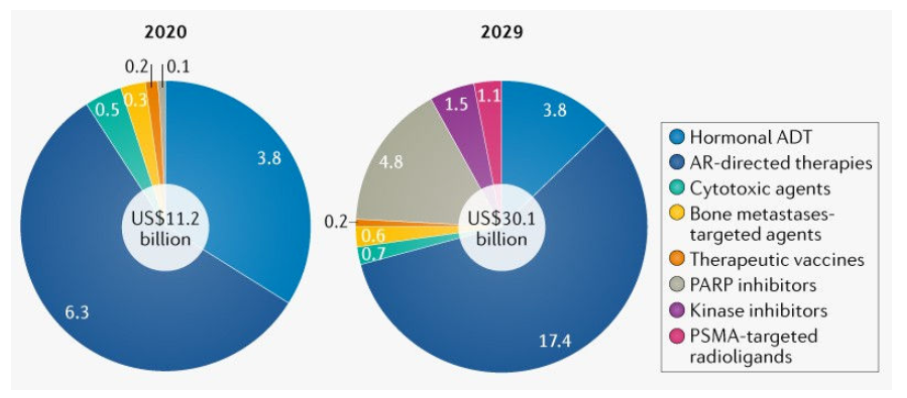
图1 前列腺癌药物治疗市场变化
从Nature预测的前列腺癌药物市场看,整体前列腺癌药物市场体量会增大近2倍,将在2029年达到300亿美元,这其中传统去势治疗ADT使用将减少,以重磅炸弹药物Zytiga(醋酸阿比特龙)和Xtandi(恩杂鲁胺)为主的雄激素受体(AR)拮抗剂颠覆了转移性前列腺癌的治疗格局,市场占有量将继续增大,PARP抑制剂和PSMA放射配体疗法争得一席之地的机会,包括Akt抑制剂在内的激酶抑制剂也会对细分人群起作用。
AR拮抗剂引领市场扩大
强生的Zytiga和安斯泰来/辉瑞的Xtandi分别于2011和2012年获FDA批准上市,同为AR拮抗剂,但前者通过抑制CYP17而减少雄激素的生物合成,后者则是阻止雄激素受体转运至细胞核。
强生通过上市两个AR拮抗剂药物而占据转移性前列腺癌霸主地位。一个是阿比特龙,另一个是在2013年从Aragon制药买来的阿帕鲁胺,是FDA首个批准的用于非转移性去势抵抗性前列腺癌的药物,在此之前,ADT治疗后前列腺特异性抗原(PSA)升高但无转移的CRPC患者无标准治疗选择。今年又通过肿瘤实时审评计划,批准用于与ADT联用于转移性去势敏感性前列腺癌,会成为后阿比特龙时代的主力军。
表1 FDA上市的四个第二代抗雄激素药物
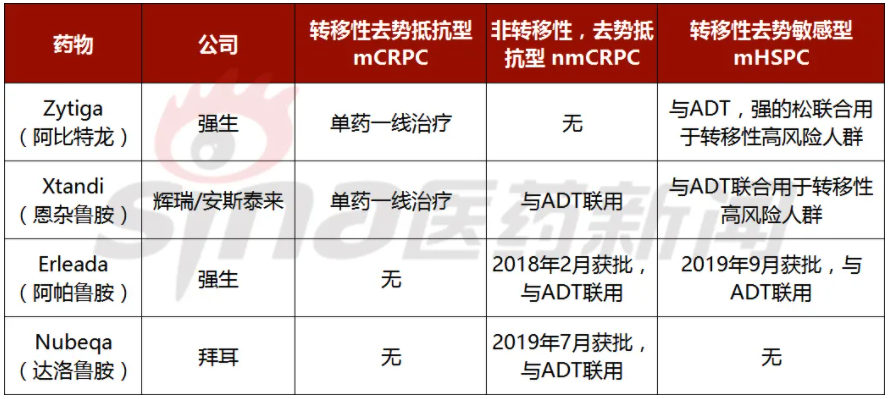
恩杂鲁胺将现在是FDA批准的第一种也是唯一一种口服治疗三种不同类型的晚期前列腺癌——非转移性和转移性去势抵抗性前列腺癌(CRPC)和mCSPC。将安斯泰来和辉瑞都带入前列腺癌治疗领域第一梯队。
当年安斯泰来花了7.65亿美元从Medivation(后被辉瑞收购)买到Xtandi(恩杂鲁胺)除美国外的商业权益,同时美国的销售额平分。安斯泰来在泌尿生殖方面有市场基础,分别在2004和2012年,先后在欧洲和日本上市了第一代抗雄激素药物,Eligard(醋酸亮丙瑞林)和Gonax(地加瑞克),还上市了几个产品也为泌尿生殖系统药物。辉瑞几乎拥有了小分子抗癌药全明星阵容——用于前列腺癌的恩杂鲁胺,和当年收购Medivation获得的他拉唑帕尼。
拜耳终于在上市针对前列腺癌骨转移的Xofigo(鐳-223)6年后进入主要治疗市场。达洛鲁胺相对于之前上市的二代抗雄激素药物主要优势是减少可能的不良反应,透过血脑屏障低能减少CNS相关不良反应。
PARP抑制剂加入前列腺癌竞争
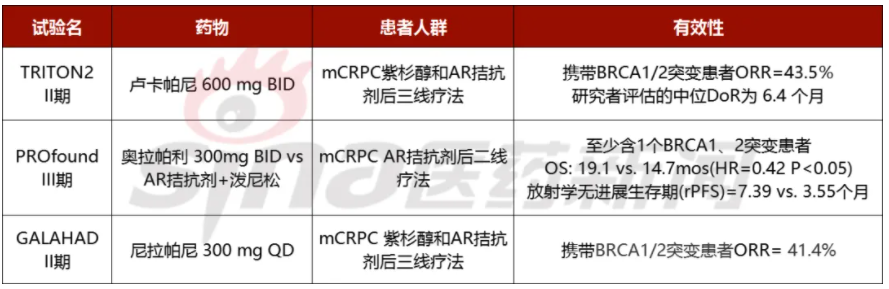
目前PARP抑制剂在前列腺癌市场没有在卵巢癌中竞争那么激烈。在2020年,两个PARP抑制剂首先被FDA批准用于AR拮抗剂经治后的mCRPC,分别是奥拉帕利和卢卡帕尼,前者用于治疗携带同源重组修复(HRR)基因改变的患者,约占20-30%的mCRPC人群,后者用于紫杉类方案化疗后进展并携带DDR基因缺陷(BRCA1/2)的患者,约占12%的mCRPC人群。从人群上来看,卢卡帕尼略受限制。
奥拉帕利是阿斯利康近10多年来前列腺癌领域批准的第一个新药,曾在20世纪90年代上市了两个第一代雄激素受体抑制剂,Zoladex(戈舍瑞林)和Casodex(比卡鲁胺)。与默沙东合作开发的PARP抑制剂Lynparza(奥拉帕利),是至今获批适应症最多的PARP抑制剂,适应症涵盖卵巢癌、胰腺癌、乳腺癌和前列腺癌。奥拉帕利销售额逐年攀升,2020年销售额高达25.01亿美元。前列腺癌适应症在中国的上市申请于6月21日获批。
卢卡帕尼是美国批准的第二款PARP抑制剂,也是首个被批准用于治疗前列腺癌的PARP抑制剂,获批的适应症包括卵巢癌和前列腺癌。目前市场表现一般,年销售额还没突破2亿美元。
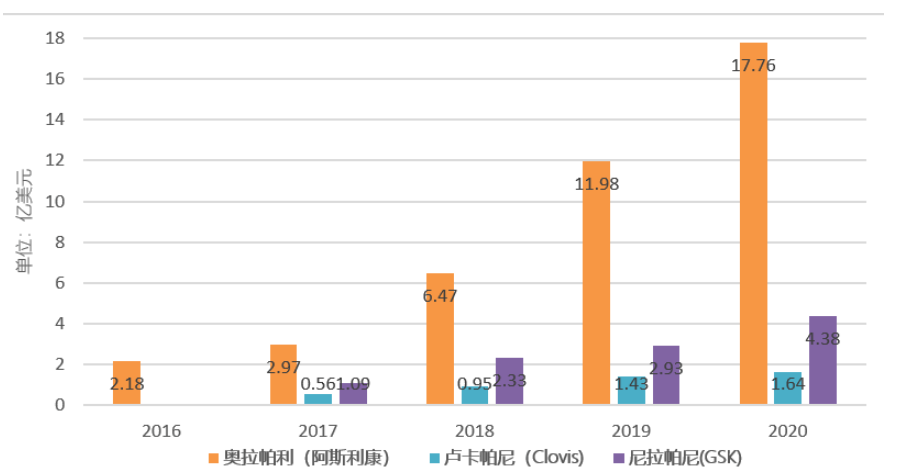
图2 三大PARP抑制剂销售额
表2 PARP抑制剂单药用于mCRPC的II/III期试验
鉴于PARP抑制剂对后线疗效已确证,PARP抑制剂相关联用也在探索。包括PARP抑制剂+AR拮抗剂可能有协同作用,PARPi+AR抑制剂联合方案一线/后线治疗mCRPC能否进一步改善生存,尼拉帕利或奥拉帕尼+阿比特龙等试验正在进行。另外,他拉唑帕尼和尼拉帕尼也都在进行与AR拮抗剂联用于mHSPC人群的试验。
在FDA批准PD-1抑制剂K药(Pembrolizumab)用于存在MMR缺失的实体瘤后,NCCN指南建议通过检测错配修复及微卫星不稳定性筛选出的错配修复缺陷(mismatch repair deficiency,dMMR)及微卫星高度不稳定(microsatellite instability-high,MSI-H)型前列腺癌患者再用K药治疗,这类人群在mCRPC中非常少,仅占2-5%,因此PARP抑制剂同样也在尝试与PD-1抑制剂联用,也许可以拓宽适应症。从机制上看,肿瘤突变负荷与DDR缺陷有关,特别是超突变肿瘤也常携带包括BRCA1/2的突变,PARP抑制介导的DNA损伤还会通过激活cGAS-STING通过增加T细胞浸润入肿瘤细胞。奥拉帕利+durvalumab,奥拉帕利+Pembrolizumab, 卢卡帕尼+nivolumab,他拉唑帕尼+avelumab等均在进行mCRPC试验。
PSMA靶向治疗和其他激酶抑制剂
前列腺特异性膜抗原(PSMA)是一种跨膜糖蛋白,在超过80%的原发性和转移性前列腺癌中都有表达,具有增殖促进的作用,其过表达还能够使前列腺细胞摆脱对雄性激素的依赖。
诺华虽然在前列腺癌领域没有产品,但希望能在放射性配体疗法抢占先机。通过在2017和2018年收购Advanced Accelerator Applications 和Endocyte获得靶向放射性疗法产品,今年ASCO公布的Lutetium-177 PSMA 617 III期试验结果,与单用最佳标准治疗相比,mCRPC患者接受177Lu-PSMA-617联合最佳标准治疗的死亡风险降低38%(中位OS获益4个月),其影像学进展或死亡风险降低60%(中位rPFS获益5个月),2021年上半年将向美国和欧盟监管部门提交新药注册申请。
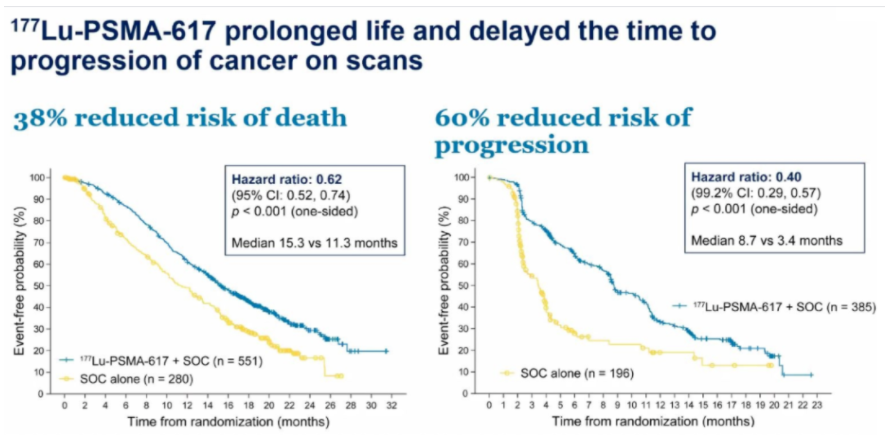
图3 名为VISION的III期试验试验结果
拜耳除了进入目前mCRPC主要市场二代抗雄激素药物市场外,也布局了PSMA靶向放射和与安进合作开发双抗。2021年6月拜耳宣布将收购两家专注开发放射配体疗法的公司,分别为Noria Therapeutics和PSMA Therapeutics公司。通过收购拜耳将获得基于同位素锕-225(actinium-225)的差异化α粒子疗法的开发权益。
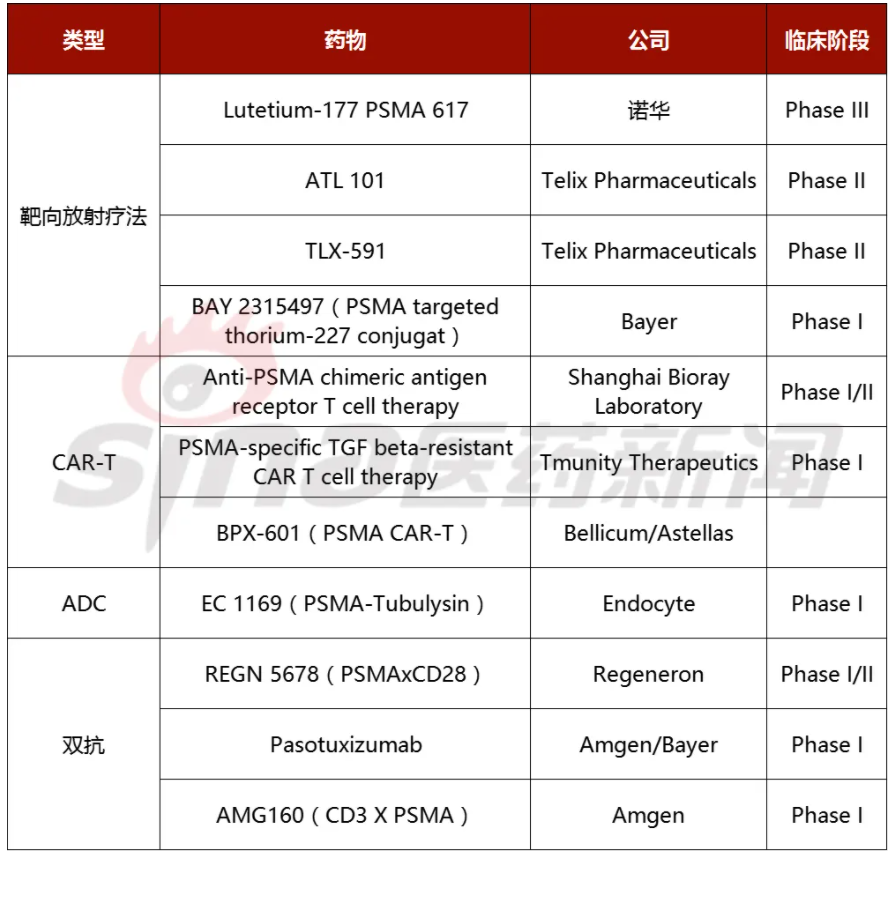
表3 主要临床阶段PSMA靶向治疗
其他激酶抑制剂临床开发得比较快的有Akt抑制剂和Cabozantinib,这两类药物也在面临不同的挑战。
Akt处于细胞生存通路PI3K/Akt/mTOR信号传导通路的核心地位,与肿瘤细胞的发生、生长及转移都紧密相关,并且在40-60%的mCRPC中发现PTEN缺失会导致PI3K/AKT通路激活,能不依赖于雄激素受体通路而促进前列腺癌细胞的生长,因此Akt抑制剂可能会对mCRPC患者有效。目前晚期临床阶段主要是罗氏的ipatasertib和AZ的capivasertib(AstraZeneca)。
罗氏并不是前列腺癌的玩家,Akt抑制剂研发多年一直没有上市产品,但是去年ESMO公布了ipatasertib+阿比特龙+泼尼松对比阿比特龙+泼尼松用于mCRPC患者,纳入了1101例患者,结果显示虽然在所有人群中rPFS显著改善,但在PTEN缺失患者中,ipatasertib组和安慰剂组的中位rPFS分别为18.5个月和16.5个月(HR=0.77,P=0.0335)。Capivasertib正在进行与阿比特龙联用于PTEN缺失的mHSPC人群试验(CAPItello-281)。目前看Akt抑制剂在mCRPC中的运用将受PTEN检测的限制。
VEGFR、MET、AXL多靶点抑制剂Cabozantinib目前正在进行与罗氏的PD-L1抑制剂atezolizumab联用对比AR拮抗剂用于AR拮抗剂经治的mCRPC患者的III期试验(CONTACT-01)。目前公布过来自两者联用实体瘤试验(Cosmic-021)中前列腺癌队列患者的数据,在去年的ASCO会议上公布过36例患者的数据,ORR达33%,而今年公司公告的101例患者数据,独立评审委员会评估ORR仅为18%,与PD-1单药的结果相差不大,这一有效数据是否能支持加速审评仍待考证。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!