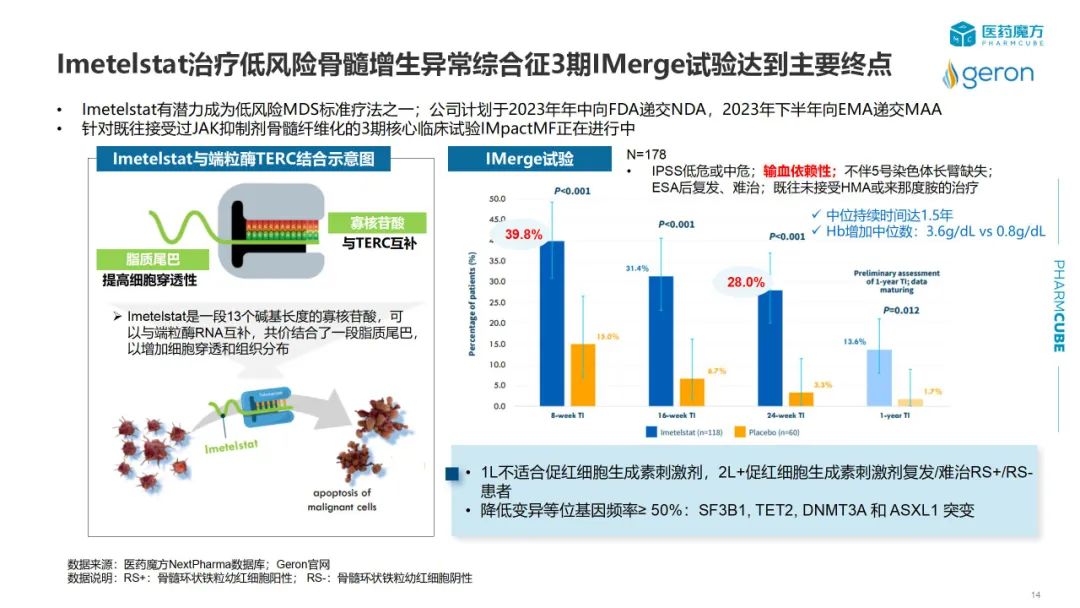
1)临床结果类:新靶点的 POC/FIRST IN HUMAN 试验结果披露,注册性临床试验结果披露,挑战标准疗法的头对头试验结果披露;2)注册进展类:突破性疗法,FIRST IN CLASS/BEST IN CLASS 产品首次获批等信息。通过每月复盘,希望帮助用户清晰回顾药品动态,挖掘相关信息,助力企业把握发展策略。1.2023年1月全球批准新药盘点:pirtobrutinib2.2023年1月美国FDA授予突破性疗法资格药物盘点:pegsitacianine3. 研发进展:1)Geron公布imetelstat治疗低风险骨髓增生异常综合征3期IMerge试验顶线结果;2)Jasper Therapeutics 公布了CD117单抗briquilimab的一项由研究者发起的1/2期临床试验的前3名患者数据2023年1月份,中国有9款创新药获批,包括1款治疗HIV-1感染的复邦德(艾诺米替),2款治疗新型冠状病毒感染的药物民得维(氘瑞米德韦)[1]和先诺欣(先诺特韦+利托那韦)[2],国内首个晚期一线绝经前乳腺癌疗法凯丽隆(利柏西利)[3],1款治疗II型糖尿病的复方制剂赛益宁(甘精胰岛素+利司那肽)[4],国内首个治疗EGFR Exon20插入突变NSCLC的小分子抑制剂安卫力(莫博赛替尼),first-in-class抗CD79b ADC药物优罗华(维泊妥珠单抗),以及两款疫苗—百克生物的带状疱疹减毒活疫苗和华兰生物的人用狂犬病疫苗。据统计,美国在1月份共批准了6款新药,这个数量与去年同期持平。其中有5款新药首次在全球获批,值得关注的是,绿叶制药自主研发的利培酮缓释微球瑞欣妥获得了美国FDA的批准,用于治疗I型双相情感障碍和精神分裂症。根据医药魔方NextPharm数据库[5]查询结果,此前绿叶制药自主研发的利斯的明多日透皮贴剂于2021年获得欧盟的批准,用于治疗阿尔茨海默病。截至目前,绿叶制药已有两款神经系统疾病领域药物获得海外监管机构的批准。2023年1月欧洲和日本暂无创新药获批。据统计,1月份中国、美国和欧盟分别有4款、3款和2款药物被授予突破性疗法资格。其中,信达生物和劲方医药合作开发的KRAS G12C抑制剂GF-105,治疗KRAS G12C突变型的晚期非小细胞肺癌[6],该适应症已进入临床3期阶段。国内处于同一研发阶段的还有诺华开发的JDQ443、再鼎引进的阿达格拉西,以及罗氏开发的RG6330。除此之外,礼来研发治疗阿尔兹海默病的靶向pGlu3-Aβ单抗donanemab、恒瑞医药自主研发用于治疗外周T细胞淋巴瘤的EZH2抑制剂SHR2554、科伦博泰研发的靶向TROP2的ADC药物SKB264,治疗非小细胞肺癌获得了NMPA授予的突破性疗法资格。美国FDA授予BTD资格药物中值得一提的是,一种用于肿瘤细胞减灭术实时显像剂pegsitacianine。这是由美国的一家创新公司OncoNano Medicine依托其独有的,超pH敏感聚合物胶束核心技术设计而成。该技术解决了传统成像技术无法实现的肿瘤特异性靶向的问题。除了显像剂,该公司利用pH活化胶束开发了一款STING激动剂ONM-501,预计在今年上半年启动首次人体试验。第二款获得突破性疗法的药物是Vaxcyte开发的24价肺炎球菌结合疫苗VAX-24。当前主流的肺炎球菌疫苗为多糖疫苗 (PPSV) 和多糖结合疫苗 (PCV),相较于PPSV疫苗只能引起短时的B细胞免疫应答,PCV引入了白喉毒素载体可引发T细胞依赖的长期免疫反应,因此成为了当前的主流疫苗。但传统偶联技术是将荚膜多糖随机连接至载体蛋白赖氨酸上,可能会阻断T细胞表位的呈递,同时,引入更多的血清型也意味着需要更多的蛋白载体,会进一步降低免疫原性,因此多价疫苗开发成为一大难点。VAX-24使用了改进版的载体蛋白eCRM,这种载体蛋白在T细胞表位以外的区域含有多个非天然氨基酸,可以通过位点特异性共价连接肺炎球菌多糖,确保不影响T细胞表位的暴露。此外,eCRM的优势还在于减少偶联时导致的结构异质性从而允许在引入更多的血清型的同时减少蛋白载体的使用。VAX-24 1/2期概念验证试验证实了这种技术的优越性,所有剂量VAX-24都显示出类似于Prevnar 20的安全性和耐受性。此外,2.2mcg VAX-24达到或超过了所有24种血清型的既定免疫原性标准,在该剂量下,VAX-24与Prevnar 20共有的20种血清型达到了OPA反应非劣效性标准,并且其中16种较Prevnar 20获得了更强的免疫反应。鉴于此,Vaxcyte计划将2.2 mcg剂量推进关键3期试验。Vaxcyte也将继续推进VAX-24在成人和婴幼儿中的临床计划,预计在2023年Q2公布65岁以上人群2期试验顶线数据。此外,Vaxcyte预计在2023年下半年递交31价肺炎球菌VAX-31的IND申请。除了Vaxcyte做出的努力外,Affinivax也提供了一种策略,他们放弃了经典的破伤风、白喉类毒素载体,选择将保守的肺炎球菌蛋白抗原和rhizavidin融合表达,并且将荚膜多糖生物素化,从而连接蛋白抗原和多糖抗原,进而引起B细胞和T细胞的免疫应答。利用这种策略开发的24价疫苗AFX3772也显示出良好的效力,并在2021年获得了FDA授予的突破性疗法称号。国内坤力生物和瑞宙生物也在进行24价多糖结合疫苗开发,具体技术细节暂未披露。2.1 Jasper Therapeutics公布briquilimab 1/2期临床试验数据同种异体造血干细胞移植(allo-HSCT)前需要去除受体造血干细胞(HSC),为供体HSC腾出生态位,并且抑制受体免疫系统防止排斥。传统的方法是使用高剂量的放疗或/和化疗,但这种方法毒性大,会带来非特异性损伤和多种不良反应。相反,基于免疫的预处理可提高靶向性,大大减少非特异性损伤。2023年1月3日,Jasper公布了briquilimab作为骨髓移植预处理方案,用于不适合标准清髓性造血干细胞移植或移植并发症高风险镰状细胞病和β地中海贫血患者1/2期临床试验(NCT05357482)中前3名镰状细胞病患者的数据。3名患者在12-16天实现了中性粒细胞植入,前2名患者在移植后60天外周血嵌合率达到了100%。移植后5个月,第一名患者总血红蛋白为13.3 g/dL,高于基线时的8 ~ 9 g/dL。结果公布当天,Jasper股价暴涨467%。随后,Jasper宣布欧盟授予briquilimab用于HSCT预处理孤儿药资格,并将专注于开发briquilimab用于慢性病和罕见病的干细胞移植,包括新增一个慢性荨麻疹适应症。2.2 Geron公布imetelstat治疗低风险骨髓增生异常综合征3期IMerge试验顶线结果[11]端粒是染色体末端的保护基团,在20世纪80年代,科学家发现端粒酶,端粒酶在对端粒的维持中发挥重要的作用。正常组织中,随细胞分裂次数的增加端粒长度缩短,当端粒短到足够程度,细胞会停止分裂、衰老或凋亡。在肿瘤细胞中,端粒酶活性增加,癌细胞可分裂更多次。端粒体酶包含催化亚基TERT、 RNA模板TERC及其他蛋白。Imetelstat是一段13个碱基长度的寡核苷酸,可以与端粒酶RNA互补,共价结合了一段脂质尾巴,以增加细胞穿透和组织分布,通过靶向抑制端粒酶活性,抑制细胞不可控的增殖,促进癌细胞的凋亡,发挥抗肿瘤活性。2023年1月份,Geron公布的IMerge试验是一项随机、双盲、安慰剂对照临床试验,旨在评估imetelstat在有输血依赖性的IPSS-低危组或中危-1组MDS患者中的疗效。主要终点为治疗8周,患者维持不依赖输血百分比(TI%),关键次要终点包括治疗24周(TI%)、TI持续时间和患者血液学指标改善情况。该研究达到了8周主要疗效终点和24周关键次要终点,均展现出具有高度统计学意义和临床意义的改善。基于此,Geron计划于2023年年中向FDA递交上市申请,并于2023年下半年向EMA递交上市申请。2.3 FDA批准EP262治疗肥大细胞介导相关疾病的IND申请MRGPRs是一种称为Mas相关G蛋白偶联受体,主要表达于皮肤、气道和胃肠道等关键屏障组织中。MRGPRX2位于肥大细胞上,当该受体被感觉神经元释放的多种配体(例如P物质等)或嗜酸性粒细胞、DC、T细胞等激活后,肥大细胞脱颗粒,释放组胺等物质,引起瘙痒、荨麻疹、血管性水肿和疼痛。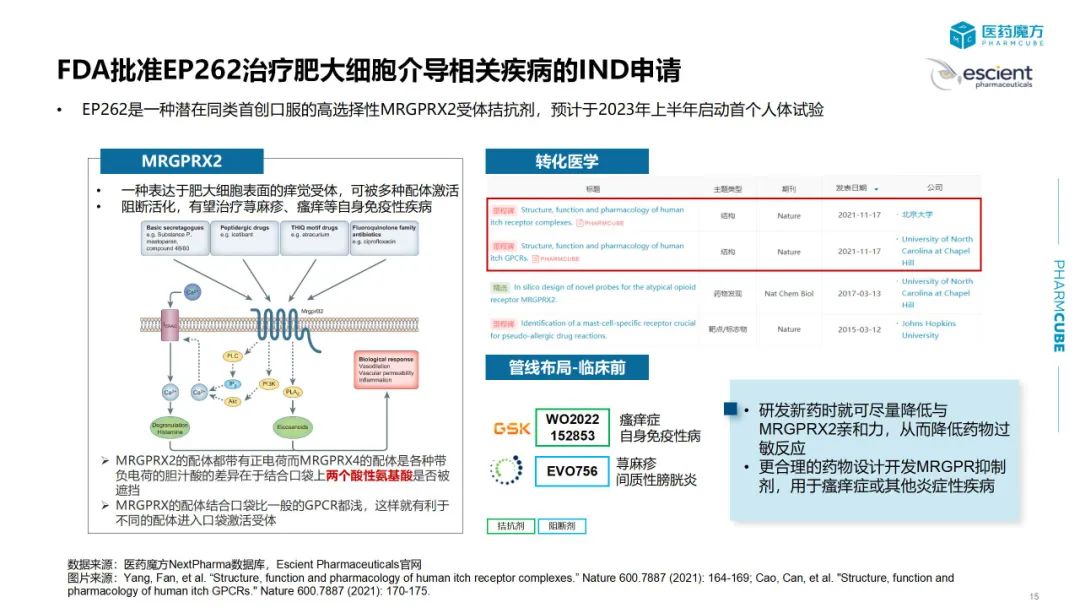
图片来源:Grimbaldeston, M.A. (2015), Mast cell-MrgprB2: sensing secretagogues or a means to overreact?. Immunol Cell Biol, 93: 221-223.
EP262能有效抑制多种MRGPRX2激动剂诱导的肥大细胞的MRGPRX2激活和脱粒,发挥拮抗剂的作用,还可以阻断人肥大细胞中胰蛋白酶和炎症细胞因子的释放。FDA批准EP262用于肥大细胞介导的疾病包括慢性荨麻疹和特应性皮炎的IND申请,该公司计划于2023年H1启动该药物的首个人体试验,评估其安全耐受性以及药代动力学性质。NextPharma数据库中以MRGPRX2为靶点且处于活跃的药物仅有三款,分别是Escient Pharmaceuticals的EP262,以及两款处于临床前的药物:Evommune的EVO756及GSK专利中的WO2022152853。三款药物的适应症多集中在荨麻疹、特应性皮炎等自身免疫性疾病。声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容