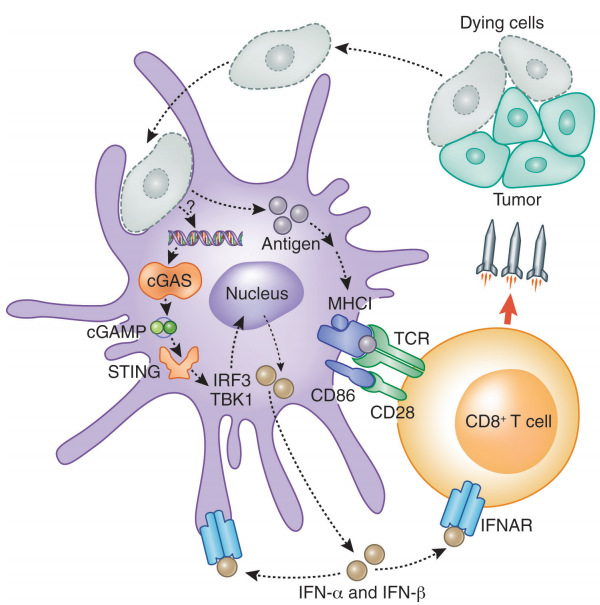
3月13日,Mersana宣布其首个免疫合成STING激动型ADC候选药物XMT-2056的I期临床试验因出现治疗相关的5级(致命)严重不良事件(SAE)而自愿暂停。与Mersana有着共同心情的还有GSK和德国默克,因为这两家制药巨头均在2022年与Mersana就其STING激动型ADC候选药物达成相关合作协议。临床暂停是否会影响到GSK和默克后续对项目的跟进还未可知。不过可以肯定的是,ADC药物因毒性导致的安全性问题仍然是整个行业需要冷静面对的难题。以PD-1/PD-L1抗体为代表的检查点阻断疗法被证明在克服肿瘤诱导的T细胞抑制方面非常有效,然而,当患者本身缺乏自发T细胞反应时,检查点阻断疗法的疗效就会很差。而先天免疫激动剂可能能够促进肿瘤特异性CD8+T细胞的启动和招募,因此是一种极具治疗潜力的癌症免疫疗法。环状GMP-AMP合成酶(cGAS)-干扰素基因刺激因子(STING)信号通路是一种胞质DNA传感通路,在先天免疫反应中起着关键作用。当肿瘤来源的DNA被胞质中的DNA感受器——cGA识别时,cGAS会催化连接两个核苷酸,形成环状二核苷酸(CDNs,如2′,3′-cGAMP),之后CDNs作为第二信使与STING结合并将其激活。STING下游的信号传导会导致抗原递呈细胞(APCs)激活以及炎性细胞因子的产生,进而促进T细胞的启动和招募[1]。科学家们认为,STING外源性激动型可能具有触发先天免疫激活的潜力,可以作为单一疗法或结合检查点阻断免疫疗法来控制肿瘤生长。
(来源:参考资料[1])
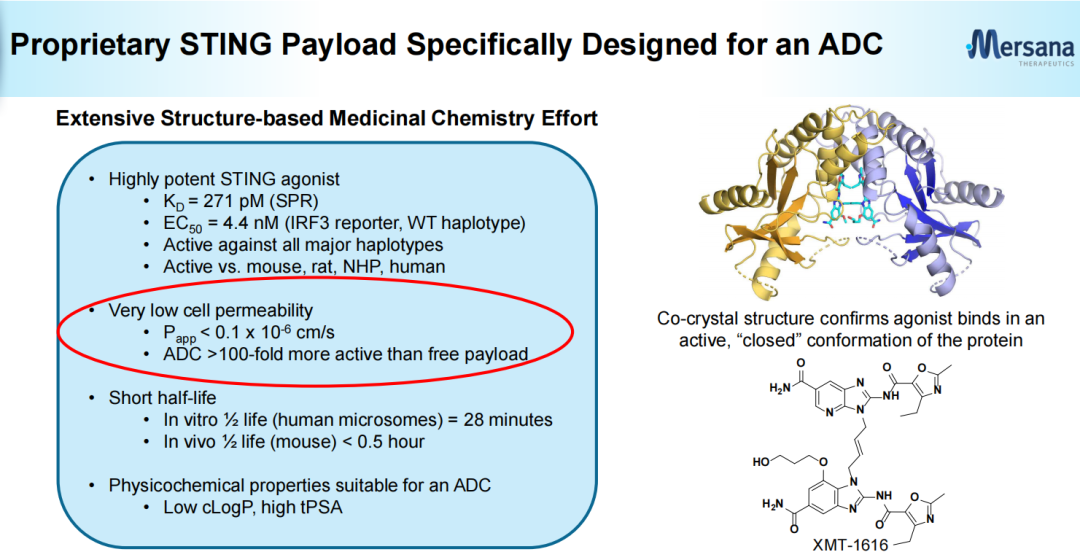
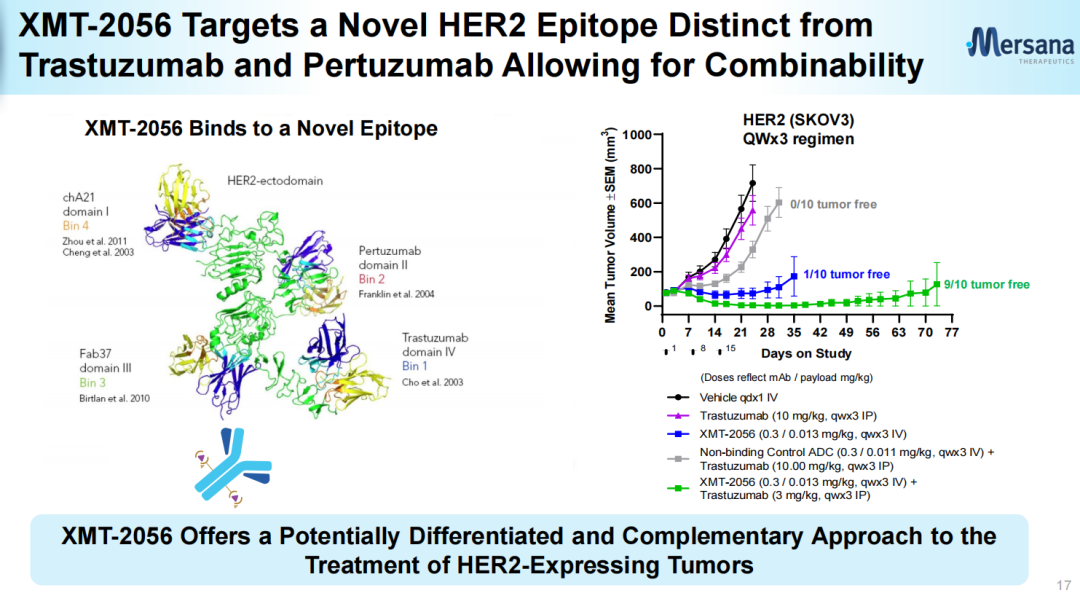
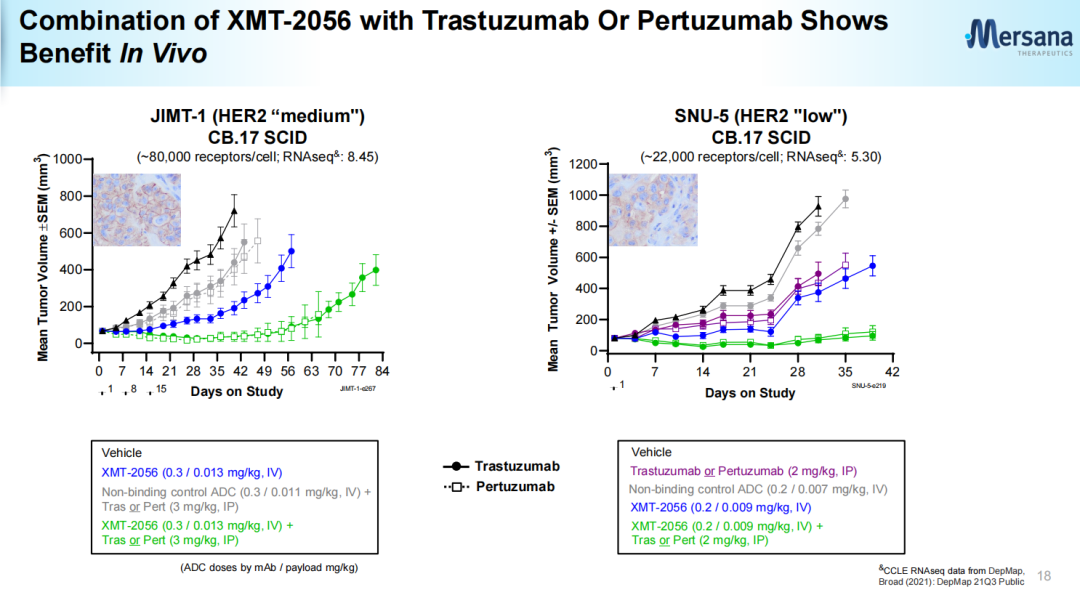
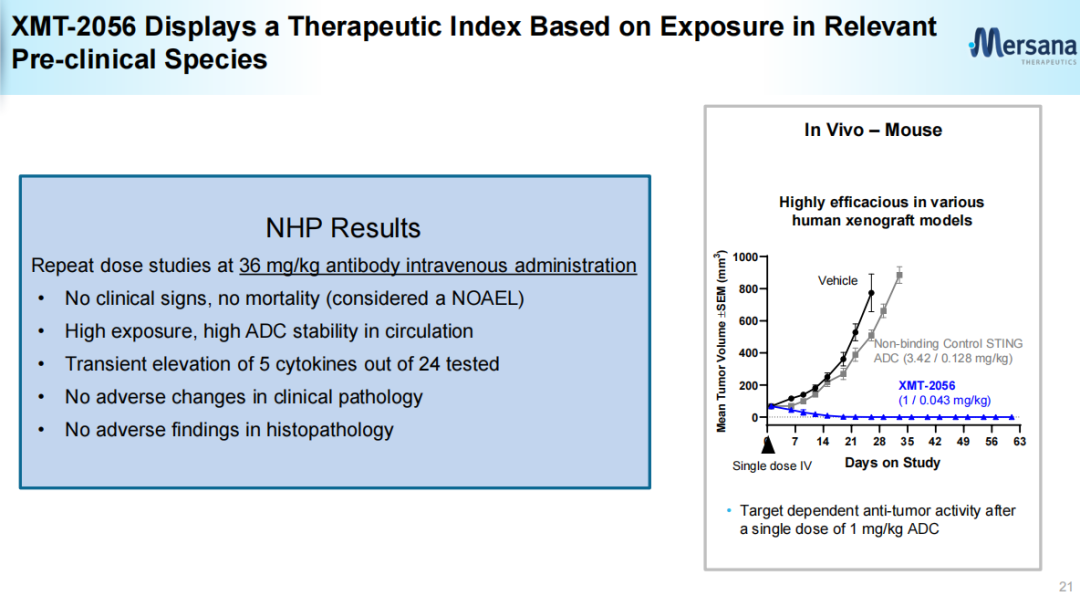
不同于目前已实现商业化上市的ADC药物以细胞毒类为载荷,基于Mersana的专有的STING激动剂平台开发的XMT-2056所采用的有效载荷为高效STING激动剂,其亲和力高(KD(解离常数)=271 pM (SPR),EC50(半最大效应浓度)=4.4 nM),细胞渗透性极低(Papp(表观渗透系数)<0.1*10-6cm/s),半衰期也较短。XMT-2056所采用的的有效载荷(Mersana官网)XMT-2056的抗体部分利用Adimab技术开发,具有差异化,虽然靶向HER2,不过结合位点不同于曲妥珠单抗或帕妥珠单抗。因此具有与后两者联用的潜力。XMT-2056靶向HER2蛋白的不同位点(Mersana官网)XMT-2056抗肿瘤活性包括靶向激活肿瘤驻留免疫细胞和以抗原结合依赖的方式激活肿瘤细胞中的STING通路。与其他仅激活免疫细胞的先天免疫方法相比,这种“组合拳”提供了增强抗肿瘤活性的潜力。Immunosynthen认为公司平台创建的ADC有潜力解决疗效、递送和耐受性方面的挑战。临床前数据表明,XMT-2056作为单一疗法在HER2高、低表达模型中均表现出强大的抗肿瘤活性。与多种已获批准的药物(曲妥珠单抗、帕妥珠单抗、PD-1抗体、德曲妥珠单抗)联合治疗时,抗肿瘤活性有所提高。临床前数据还表明,XMT-2056有可能通过免疫记忆来延长抗肿瘤活性。XMT-2056与曲妥珠单抗、帕妥珠单抗联用效果(Mersana官网)安全性方面,在重复给药剂量远远超过小鼠疗效所需剂量后(36 mg/kg静脉注射),小鼠无临床症状,无死亡案例;XMT-2056暴露浓度高,血液中ADC稳定性高;临床病理无不良改变,组织病理学也无不良表现。不过,人体试验中5级不良事件的出现也再次使该候选药物的成药性遭到质疑。众多行业人员对此事件进行了点评:行业人士煮酒论药:XMT-2056在剂量爬坡的第一个剂量就出现致命的毒副作用在意料之中,其问题从临床前研究就显而易见。抑制剂的作用最多是实现100%抑制,而激动剂则可能无限放大,因而对每个通道的信号,每个化学设计,每个临床前信号反馈,每个安全性反馈都要严格审视[2]。行业人士追溯:XMT-2056本身成药性不强,但这个方向值得去尝试。主要原因是XMT-2056 0.3mg/kg的药效已十分明显,1mg/kg已经是非常优异了。激动剂的活性与杀伤性ADC很像,药效跟毒性成正相关。激动型ADC开发难度可能比杀伤性ADC更大,单独用药的情况下,临床前未必就一定会很好,而且需要良好的安全性窗口[3]。追溯表示,无论是何种类型有效载荷,TLR7/8或者STING都有成药的可能,关键是如何把握有效载荷的活性,以及未来临床的试验设计细节。2008年STING被首次报道,2012年底STING上游通路的关键分子cGAS和第二信使cGAMP被揭示。2013年,Aduro公司在SITC年会上展示了其环二核苷酸类(CDN)STING激动剂ADU-S100的临床前研究数据,紧接着诺华与其达成共同开发协议,使得该化合物在2016年便进入I期临床。随着STING作用机制的阐明和转化医学的研究,BMS、默沙东、武田、GSK等制药巨头纷纷开始了STING激动剂药物的布局。2017年初,默沙东启动了Keytruda联合STING激动剂MK-1454的临床研究;2017年8月,BMS与IFM Therapeutics公司达成了一项针对STING激动剂的收购交易。根据协议,IFM Therapeutic可从BMS获得3亿美元预付款和20亿美元里程金。STING激动剂从发现到进入临床较为顺利,仅用了不到10年时间。但是新药临床研发往往在波折中前行,2019年Aduro公布瘤内注射给药ADU-S100的I期临床试验结果不佳,年底诺华宣布终止了ADU-S100的合作开发,Aduro后续也停止了II期临床试验;而默沙东的MK-1454也因疗效甚微,目前无进展。主要原因是这类药物稳定性较差,只能通过瘤内注射给药,为后续的开发和临床应用带来一定的困难[4]。不过,临床失败并没有打击科研人员的热情,GSK、Taketa、Silicon Therapeutics、成都先导等公司开发的非环二核苷酸类小分子STING激动剂已进入了早期临床研究阶段。其他靶向STING的药物类型,比如ADC、细胞疗法、外泌体、saRNA疗法、STING PROTAC等也孕育而生。ADC作为当前最热门、最有潜力的赛道。基于STING靶点开发抗体偶联药物也成为了一种新的开发选择。根据医药魔方NextPharma数据库,目前在研的60多项STING激动剂项目中,STING激动ADC在研药物数量仅次于小分子。除了Immunosynthen外,武田也将一款STING激活CCR2靶向ADC候选药物TAK-500推向了I期临床。另外10款ADC候选药物尚处于临床前研究阶段。第一三共、加科思、Seagen (辉瑞)、Spring Bank Pharmaceuticals(中国生物制药)均有布局。也有研究发现,STING的过度信号传导与一系列慢性疾病和罕见病的发病相关,其中包括肺纤维化、非酒精性脂肪性肝炎(NASH)、自身免疫性疾病等。因此也有药企和科研院所布局了STING抑制剂,比如诺华、BMS、礼来、拜耳、阿斯利康、中国药科大学等。
总结

药物的开发是一个不断摸索的过程,STING靶向药物的开发亦是如此。临床失败是总结经验的过程。后来者也将会在前人走过的路的基础上不断优化,改进,直至将药品推向市场造福患者。
[1] Regulation and function of the cGAS–STING pathway of cytosolic DNA sensing. doi:10.1038/ni.3558[3] GSK再次打水漂,Mersana激动型HER2 ADC导致死亡事件发生,临床暂停(公众号: Antibody Research)[4] Antitumor activity of a systemic STING-activating non-nucleotide cGAMP mimetic. doi: 10.1126/science.abb4255.
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容