
2023-09-13 12:06:36来源:求实药社浏览量:2652
与ADC、SMDC等类似,RDC主要由介导靶向定位作用的抗体或小分子(Ligand)、连接臂(Linker)、螯合物(Chelator)和放射/成像因子(放射性同位素,radioisotope)构成。
RDC与其他偶联药物之间最大的差异是药物载荷。RDC的载荷不再是毒性分子,而是放射性核素;使用不同的放射性核素,可以启到显像或治疗的不同功能,部分核素甚至兼备两种能力;由于放射性核素不需要与细胞直接接触,RDC的Linker在起效过程中不需要断裂,这进一步提高了RDC药物在体内的稳定性和安全性。
RDC药物在国外研发进度较快,Novartis是该领域的领跑者,拥有多款RDC药物。POINT Biopharma、Telix、ITM、拜耳等也在积极布局RDC赛道,多款肿瘤治疗产品处于临床阶段。2016年以来,FDA一共批准了九款RDC药物,涉及6个新分子实体。RDC虽然不似ADC药物那样火热,但已经有越来越多的新药进入市场。
从靶点上看,RDC药物以靶向前列腺特异性膜抗原(PSMA)的项目居多,同时也涉及在ADC药物中较受欢迎的Her2靶标,在适应症上,RDC药物主要集中在肿瘤领域。目前,全球已上市的RDC治疗药物表现突出的主要为Lutathera和Pluvicto两款。
其中,Lutathera是FDA批准的第一个治疗胃肠胰神经内分泌肿瘤的放射性药物,2021年销售额4.75亿美元。该产品已经于2020年7月在国内提交临床申请。目前Lutathera已在美国、欧盟、法国、加拿大、中国台湾获批,中国II期临床在进行中。虽然由于疫情,市场空间有限等原因销量基本停滞不前。但Lutathera在RDC治疗药物商业化的道路上吸引了全世界药企的关注,推动了后续产品的临床应用。
Pluvicto是Novartis的另一款RDC药物,同样也是通过收购的方式从Endocyte获得。Pluvicto于2022年3月获得FDA批准,用于治疗去势抵抗性转移前列腺癌患者(mCRPC)。
已披露的临床研究结果显示,Pluvicto在mCRPC的治疗中,相比目前临床表现最好的PARP抑制剂奥拉帕利,在mPFS上比奥拉帕利略胜一筹,OS不相上下;安全性数据基本没差别,甚至不良反应发生率略低。
在市场需求上,前列腺癌是男性第二大癌种,但奥拉帕利只能覆盖HRR突变的mCRPC患者,占总体患者的约15%-30%。而Pluvicto覆盖的PSMA阳性患者占到mCRPC患者的约80%,可以极大的补全PARP抑制剂治疗获益较差的患者,市场空间巨大。
2016年以来FDA批准的RDC药物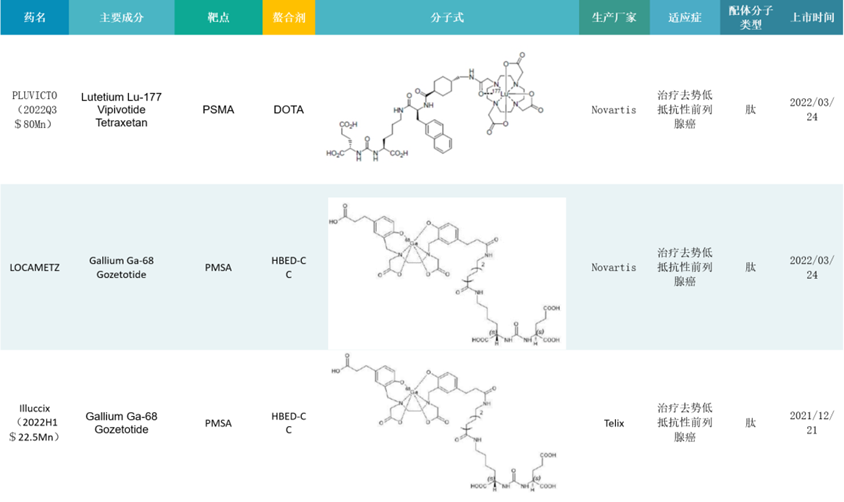


与此同时,国内也有多家企业进行了RDC药物的开发,其中:
远大医药是国内RDC领域的领头企业;自2018年开始,通过坚持全球化布局的发展战略,远大医药联合Sirtex、参股公司Telix以及日前合作的德国ITM公司,在抗肿瘤领域逐渐搭建了具有国际化一流水平的核药诊疗平台,在全球核药领域实现了全产业链——研发、生产、销售、监管资质等多领域的全方位布局。公司重点布局的放射性药物诊疗平台现已拥有10款全球创新产品,包括钇[90Y]微球注射液及其余9款RDC药物,涵盖68Ga、177Lu、131I、90Y、89Zr、99mTc在内的6种核素,适应症覆盖肝癌、前列腺癌、透明细胞肾细胞癌、胶质母细胞瘤、胃肠胰腺神经内分泌瘤及恶性肿瘤骨转移等。

远大医药抗肿瘤领域产品管线 来源:官网
智核生物是一家处于临床阶段的生物医药研发公司,已累计获得4轮融资。拥有单域抗体同位素偶联药物(SRC)技术平台,自主研发的以单域抗体为配体的RDC药物,包括显影诊断和治疗药物,能提高RDC药物的安全性和有效性,相关RDC治疗产品目前处于临床前阶段。


智核生物研发管线 来源:官网
辐联医药致力于开发放射性核素偶联药物(RDC)研发,自创立之日起,创始人兼CEO孙沛淇就对辐联医药在全球的研发、临床研究和供应进行了布局。目前,辐联医药有超过30%的人常驻比利时。去年8月,辐联医药任命了James McCarter博士作为欧洲团队的副总裁、放射性同位素研究负责人;今年1月,首席医学官(CMO)Steffen Heeger博士到任,带领辐联医药海外团队的临床开发。
全球化的布局,使辐联医药能够利用不同国家和地区的优势加速核药开发,例如比利时在核素生产和供应方面的优势,德国在核药临床研究方面的政策优势,以及中国在纳米抗体和多肽研发方面的优势等。
核欣医药研发产品的主要适应症是多种复发及难治性肿瘤,拥有全球首创的双靶点放射诊断治疗一体化专利技术,首个产品68Ga-HX01项目已于2022年6月获得了国家药监局(NMPA)的《药物临床试验通知书》,是全球首个获得临床批件的双靶点核药产品、是国内首批创新性68Ga药物,现已进入Ⅰ期临床。截至目前,公司的第二个产品已进入临床前开发阶段,1款177Lu双靶点治疗类1类新药正在IIT准备阶段,预计今年上半年可以开始IIT研究;6款针对不同靶点的RDC药物已经处于临床前研发阶段;预计在2025年可实现首个产品市场化。
苏州博锐创合医药有限公司于2018年由药明康德帮助北京大学分子工程苏南研究院孵化成立。公司充分利用北京大学基础研究成果,致力于打造新一代放射性靶向药物研发、生产及临床应用平台。公司目前布局产品均为自主研发,拥有全球知识产权。公司的研发管线拥有多个FIC/BIC核素偶联药物及中子俘获治疗药物,涉及多个不同适应症包括头颈部肿瘤、脑部肿瘤等的诊断与治疗产品。
晶核生物成立于2021年,致力于开发下一代靶向放射性核素疗法(TRT)。晶核生物由四位科学家联合创建,他们在TRT领域拥有多年的新药开发经验。晶核生物在公司创建之初就构建了核药开发的关键性专有技术平台,用于配体筛选、调制偶联因子(J-Linker技术)和临床转化等,从而使其产品管线快速推进。此前,晶核生物曾获得由高榕资本领投,VI Ventures、骊宸资本及凯泰资本跟投的近亿元人民币天使轮融资,以及由凯泰资本和沂景资本领投的数千万元种子轮融资。2023年5月,晶核生物宣布其利用自有技术平台开发的「镥[177Lu]JH020002注射液」(管线代号为:JH02)产品临床申请正式取得CDE受理。
 CDE公示信息
CDE公示信息
据悉,JH02适应症为前列腺癌,属于RDC(靶向放射性核素疗法,也称“TRT”)范畴——这是目前临床实操中唯一能够实现诊疗一体化的药物。作为一类创新PSMA靶向核素药物,JH02与诺华2022年获批FDA的Pluvicto同类,据介绍,JH02在动物实验中表现出更高的使用剂量安全性、更优的治疗效果及更简单的生产工艺。
JH02获CDE审理,也标志着中国创新靶向核药的自主研发正加速向临床阶段迈进,填补了国内诊疗一体核药研发空白。
总体来看,RDC药物凭借其在疾病诊断和治疗上独特的优势,在全球范围内正在受到越来越多的关注,已有产品上市并有多款产品在研发过程中。但是,受诊断设备、核素原料、技术水平及配送限制等影响,中国RDC创新仍处于初级阶段,因其壁垒高,专注于创新RDC开发的企业较少。随着核素供应支持、研发技术指导原则发布及监管政策驱动,中国RDC创新加速,市场将持续扩容。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容