
2023-11-02 09:54:25来源:霍德生物浏览量:1588
监管趋势
01 CDE发布《人源干细胞产品非临床研究技术指导原则(征求意见稿)》

为规范和指导人源干细胞产品的非临床研究,国家药品监督管理局药品审评中心在前期调研的基础上,结合国内外相关法规和技术要求,以及对该类产品当前技术发展和科学的认知,撰写形成了《人源干细胞产品非临床研究技术指导原则(征求意见稿)》,2023年10月7日公开征求意见和建议。征求意见时限为自发布之日起1个月。
信息来源于CDE
02 国家药监局:已批准100余个细胞和基因治疗产品开展临床试验
2023年10月7日,国家药监局网站发布《关于政协第十四届全国委员会第一次会议第02469号(医疗卫生类215号)提案答复的函》(以下简称《答复》)。《答复》指出,为规范和推动我国细胞和基因治疗等精准医学产品的研发和注册申报,自2019年开始,国家药监局持续开展包括肿瘤主动免疫治疗产品在内的生物医药新技术产品的监管科学和评价体系研究。经过广泛调研和专家研讨,发布了免疫细胞治疗产品、溶瘤病毒、基因治疗等产品研发相关的药学、非临床和临床试验技术指南,并于2023年4月发布《肿瘤主动免疫治疗产品临床试验技术指导原则》。截至目前,国家药监局已批准100余个细胞和基因治疗产品开展临床试验,其中包括多种技术路线的个体化肿瘤主动免疫治疗产品。
信息来源于国家药监局
03 Cell Prolif | 《人神经干细胞》团体标准发表
2023年10月18日,国际期刊Cell Proliferation发表了《人神经干细胞》团体标准,其是由中国干细胞研究学会专家共同起草并达成共识的第一个中国标准。该标准规定了人神经干细胞(hNSCs)的技术要求、测试方法、测试规定、使用说明、标签要求、包装要求、贮存要求、运输要求和废弃物处理要求,适用于hNSCs的质量控制。该标准最初由中国细胞生物学学会于2022年8月30日发布。希望该标准的出版能促进机构的建立、接受和执行适当的协议,并加速国际标准化的hNSCs的临床开发和治疗应用。
信息来源于Cell Proliferation期刊
04 Cell Stem Cell | 彭耀进/高建超解析中国司法对干细胞干预监管属性的认知

2023年10月5日,中国科学院动物研究所、北京干细胞与再生医学研究院彭耀进研究团队与国家药品监督管理局药品评价中心高建超团队合作,在Cell Stem Cell期刊发表了题为《The Variability of Judicial Decisions in the Stem Cell Industry in China》的政策论文。该研究首次通过分析案例,探索中国司法对干细胞监管属性的理解和态度,分析判决的潜在逻辑规律和成因,并评估其对产业、学术界和公众的影响,提出了一系列针对性和可行的建议,以促进干细胞相关司法实践与领域健康发展之间的良性互动与平衡。这项研究为探索其他前沿生物医药领域的法律问题提供了有益的参考路径,希望推动解决干细胞转化监管的现实难题,推动高质量、可持续发展的干细胞研究和转化。
信息来源于Cell Stem Cell期刊
05 科技部发布《科技伦理审查办法(试行)》
2023年10月8日,由科技部、教育部、工业和信息化部等十部门联合印发的《科技伦理审查办法(试行)》正式公布,意在规范科学研究、技术开发等科技活动的科技伦理审查工作,强化科技伦理风险防控,促进负责任创新。
信息来源于科技部
06 CDE发布关于《药物临床试验样本量估计指导原则(征求意见稿)》公开征求意见的通知
样本量估计是药物临床试验设计的重要组成部分,也是确保研究具有合理性、准确性、可靠性和完整性的重要手段。通常,临床试验的样本量必须足够大,以可靠地回答研究假设所针对的临床问题。鉴于临床试验样本量估计的复杂性和重要性,药品审评中心组织起草了《药物临床试验样本量估计指导原则(征求意见稿)》,2023年10月30日公开征求意见。征求意见时限为自发布之日起1个月。
信息来源于CDE
07 国家药监局 国家卫生健康委关于发布实施《中华人民共和国药典》(2020年版)第一增补本的公告(2023年第126号)
《中华人民共和国药典》(2020年版)第一增补本已编制完成,2023年10月12日发布,自2024年3月12日起施行。
相关增补内容包括:修订生物制品通则《生物制品生产用原材料及辅料质量控制》、《生物制品生产检定用菌毒种管理及质量控制》;新增通则3309《体外热原检查法(报告基因法)》、9404《基于基因修饰细胞系的生物检定法指导原则》、9406《细胞类制品微生物检查指导原则》;修改通则和技术指导原则3601《生物制品生产及检定用实验动物质量控制》等。
信息来源于国家药监局
08 CDE关于发布《药物临床试验方案提交与审评工作规范》的通告

为提高药品注册申请人撰写临床试验方案的质量,规范临床试验方案有关沟通交流和各类注册申请,提高临床试验方案的审评质量,药审中心组织制定了《药物临床试验方案提交与审评工作规范》,2023年10月12日发布,自发布之日起施行。
本工作规范适用于临床试验申请、补充申请、沟通交流申请和临床试验方案登记等涉及临床试验方案的资料提交与审评,尤其是针对确证性临床试验(或关键性临床试验)方案。
信息来源于CDE
09 FDA发布《再生医学疗法自愿共识标准认可计划》

2023年10月19日,美国食品药品监督管理局(FDA)发布了《再生医学疗法自愿共识标准认可计划》指南。自愿性共识标准是为医疗产品各个方面的开发提供“共识方法”的一种手段,例如评估安全性和有效性,测试方法,验收标准,并允许这些标准国际统一,使符合监管标准的过程更有效和更具规范性。因此,通过自愿性共识标准,FDA可以简化其审查过程。
信息来源于FDA
行业动向
01 mRNA疫苗开发者斩获诺贝尔生理学或医学奖

2023年10月2日下午,诺贝尔委员会宣布授予Katalin Kariko博士和Drew Weissman博士2023年诺贝尔生理学或医学奖,以表彰他们在mRNA疫苗领域的突破性贡献。在全球爆发的新冠疫情中,基于mRNA技术的新冠疫苗以前所未有的速度问世,为无数人提供了保护,也改变了全球抗疫的格局。将这一荣誉颁发给Kariko博士和Weissman博士无疑是众望所归,以表彰他们在该领域的卓越成就和重大影响。
信息来源于网络
02 拜耳斥资2.5亿美元新建细胞疗法生产工厂

拜耳宣布投资2.5亿美元在美国加州伯克利建立一家细胞疗法生产工厂,以支持后期临床试验和新产品的推出。该工厂将首先生产BlueRock Therapeutics治疗帕金森病的实验性细胞疗法bemdaneprocel所需的材料。拜耳计划在2024年上半年开始进行二期试验,并表示这个新设施将确保细胞疗法的投资成为全球患者的现实。
BlueRock Therapeutics总裁兼首席执行官Seth Ettenberg表示,能够使用这个新的细胞疗法生产设施对于向有需要的患者提供有影响力的细胞疗法非常重要,他们希望扩大该疗法的生产。这个新工厂是拜耳为加强蛋白质治疗、细胞和基因治疗的生物制剂管线而进行的一系列投资之一,利用Biotech@Bayer的专业知识为细胞培养、病毒转导和细胞疗法提供灵活的模块化空间。除了伯克利的工厂,拜耳在德国和瑞士还设有生物技术团队和实验室。
信息来源于网络
03 全球首款体内CRISPR基因编辑疗法获FDA批准Ⅲ期临床试验
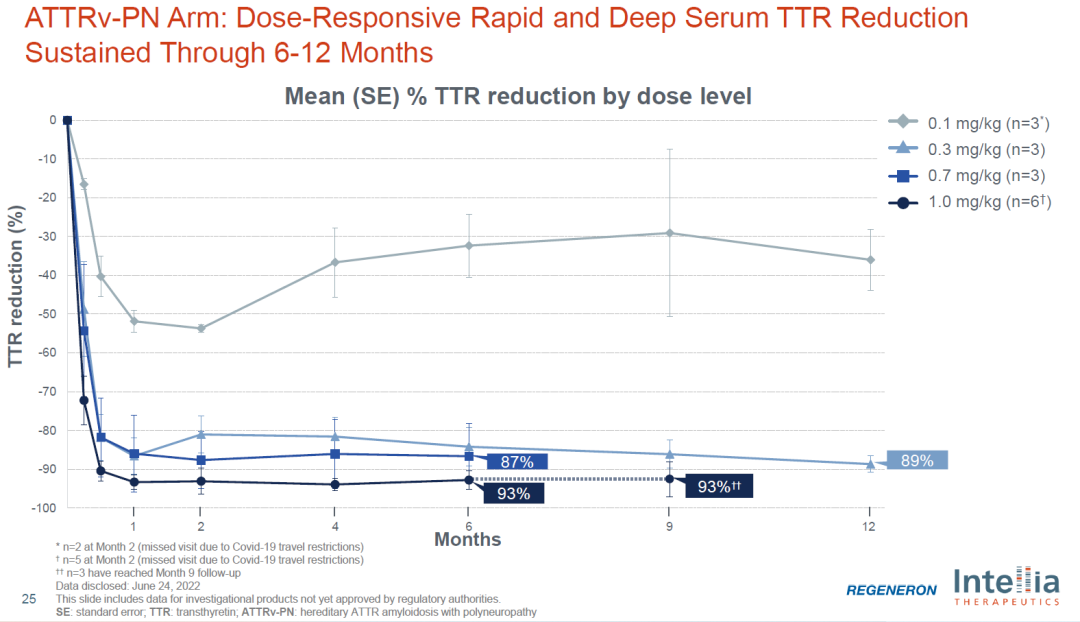
Intellia Therapeutics在2023年10月18日宣布,美国食品药品监督管理局(FDA)已批准其基于CRISPR的转甲状腺素蛋白(ATTR)淀粉样变性心肌病疗法NTLA-2001开展Ⅲ期临床试验。NTLA-2001是Intellia Therapeutics(CRISPR基因编辑技术的奠基人、诺贝尔奖得主詹妮弗·杜德娜(Jennifer Doudna)创立的)与再生元公司合作开发的首个产品,也是全球首款体内CRISPR基因编辑疗法。该疗法利用脂质纳米颗粒(LNP)载体将携带靶向致病基因TTR的sgRNA和优化的spCas9蛋白的mRNA序列传递到肝脏,用于治疗转甲状腺素蛋白淀粉样变性心肌病。
早期临床数据显示,在6名接受治疗的患者中,经过28天的治疗,两种不同剂量组的患者血清中TTR蛋白水平平均下降分别为52%和87%,且未观察到严重不良反应。这次FDA批准NTLA-2001进入III期临床试验被认为是基因编辑领域的重大里程碑,因为全球范围内,FDA一直对于直接编辑患者体内DNA的疗法持谨慎态度,其监管要求甚至比其他地区的监管机构更为严格。
信息来源于网络
04 瑞吉康针对渐冻症AAV基因治疗药物获FDA孤儿药资格认定

10月16日,上海瑞吉康生物医药有限公司(瑞吉康)宣布,其AAV基因治疗药物RJK002,用于治疗肌萎缩侧索硬化(ALS),已获得美国食品药品监督管理局(FDA)的孤儿药资格认定。这是中国首个获得FDA孤儿药资格认定的渐冻症AAV基因治疗药物。获得孤儿药资格认定将加速RJK002的临床试验和上市注册进程,并享受政策支持,包括税收抵免、免除新药申请费以及7年的市场独占权。瑞吉康的RJK系列多肽药物有望解决渐冻症领域治疗的瓶颈,通过“溶解”异常聚集的蛋白质,恢复其生理功能,从而治疗退行性疾病。RJK002已在中国的IIT研究中实现首例患者给药,并计划于2023年12月正式提交中国和美国的IND临床试验申请。
信息来源于网络
05 CRISPR基因编辑技术平台性专利在我国被宣告部分无效

10月20日,株式会社图尔金向中国国家知识产权局提出了布罗德研究所的专利CN201380070567.X的无效宣告请求。该专利是美国核心专利US8697359B1在中国的对应专利,其中包括保护CRISPR-Cas复合物的组合物和CRISPR-Cas的载体系统。值得注意的是,本次无效认定为部分无效,CRISPR基因编辑的核心技术仍受到原专利的保护。申请人株式会社图尔金和专利持有方布罗德研究所都有可能对这一决定提起上诉。此外,株式会社图尔金是一家韩国上市公司,专注于基因编辑专利的授权和合作业务。
CRISPR-Cas9作为第三代基因编辑技术,具有低成本、高效率和易操作等优点,已成为主流编辑工具,引起科技竞争的关注。关于该技术的发明归属一直存在争议。2020年诺贝尔化学奖得主詹妮弗·杜德纳(Jennifer Doudna)和埃玛纽埃尔·卡彭蒂耶(Emmanuelle Charpentier)的CVC团队持有中国基因修饰方法CRISPR-Cas9的基础专利ZL201380038920.6,该专利也曾在中国面临无效宣告请求。中国专利局审查员对该专利进行了全面审查,并对其中的权利要求进行了详细审查。此次无效宣告请求则是针对专利的权利要求1-57进行的。
信息来源于网络
06 扎克伯格进军细胞行业,计划投资2.5亿美元

近期,马克·扎克伯格和普莉希拉·陈宣布将在未来十年内投资2.5亿美元在纽约市建立一个名为"细胞生物中心"的项目。这个中心旨在开发一种新型细胞机器,用于监测人体并消灭疾病。他们的愿景是通过精确解码免疫细胞的工作方式,解决癌症和阿尔茨海默氏症等疾病。该中心由耶鲁大学、哥伦比亚大学和洛克菲勒大学的研究人员组成,致力于设计能够检测和治疗免疫系统无法解决的细胞问题的机器。尽管这一愿景超出了目前细胞医学的水平,但随着免疫学和细胞工程的进展,这一项目有望成为现实,为人类提供更先进的疾病治疗方法。
信息来源于网络
07 Aspen Neuroscience帕金森病细胞疗法获FDA快速通道资格认定
近日,Aspen Neuroscience宣布其专注于开发自体细胞疗法的核心管线ANPD001已获得美国FDA的快速通道指定,用于治疗帕金森病(PD)。ANPD001是一种个性化的自体细胞疗法,通过替换丢失的多巴胺神经元来治疗帕金森病。此前,FDA已正式批准ANPD001进入1/2a期临床试验,Aspen计划启动面向中重度PD患者的首个1/2a期临床试验。该公司已于2022年进行了试验准备筛选队列研究,以筛选和招募潜在候选患者,并开始制造细胞。这项研究将是美国首个多中心的自体iPSC衍生疗法1/2a期临床试验。Aspen利用自体方法,利用患者的皮肤细胞开发诱导型多能干细胞(iPSCs),生产多巴胺神经元前体细胞(DANPCs)。在种植之前,这些细胞将通过Aspen的专有人工智能基因组测试等严格质量控制检测进行评估。除了ANPD001外,Aspen还开发了第二个产品ANPD002,结合了基因校正和自体神经元疗法,用于治疗帕金森氏病的遗传形式。
信息来源于网络
08 NKGen Biotech治疗阿尔茨海默的NK疗法获批IND
NKGen Biotech近日宣布,美国FDA已批准其NK细胞疗法SNK01用于治疗中度阿尔茨海默病(AD)的IND申请。预计该疗法将于今年年底开始对30名参与1/2a期临床试验的患者进行给药,并计划于2024年第三季度发布数据。SNK01是一种非基因修饰的自体NK细胞疗法,通过从患者的血液中分离和筛选目标NK细胞,然后激活和扩增这些细胞。SNK01具有增强的细胞毒性和激活受体表达,并且通过NKGen的冷冻保存工艺保持活性和细胞毒性。此前在世界神经病学大会上展示的中期数据显示,SNK01对AD患者具有良好的耐受性,可以穿透血脑屏障,并显示出有效减少神经炎症的迹象,这对于治疗阿尔茨海默病至关重要。NKGen的首席执行官表示,这次批准是该公司神经退行性疾病项目的重要里程碑,使他们能够针对更严重的患者群体进行治疗。
信息来源于网络
09 Vertex公布其细胞疗法VX-880的长期积极结果

10月初,Vertex Pharmaceuticals,总部位于马萨诸塞州波士顿的生物制药公司,公布了其干细胞衍生疗法VX-880的I/II期临床试验A阶段和B阶段的长期结果。这些结果显示,所有接受VX-880治疗的患者在超过90天的随访中都实现了胰岛细胞植入和葡萄糖响应性胰岛素产生。患者的血糖控制指标均有改善,包括HbA1c下降、血糖范围内的上升以及胰岛素使用的减少或消除。两名至少随访1年的患者达到了主要终点标准,即消除严重低血糖事件和糖化血红蛋白水平低于7.0%。VX-880通常具有良好的耐受性。此外,早期数据显示,三分之一的患者在接受VX-880治疗后实现了胰岛素独立。这些结果表明VX-880具有潜力改善糖尿病患者的胰岛素产生和血糖控制。Vertex还在进行其他糖尿病治疗候选药物的研究,包括VX-264,该疗法无需免疫抑制治疗。
信息来源于网络
10 绿叶制药阿尔茨海默病疗法在中国获批


10月31日,中国国家药监局(NMPA)官网显示,绿叶制药以注册分类5.1类申报的利斯的明透皮贴剂(一周两次)的上市申请已获得批准。根据绿叶制药早先新闻稿,这是一款一周两次、经皮肤给药的利斯的明改良贴剂(研发代号LY03013),本次获批用于治疗轻、中度阿尔茨海默病的症状。LY03013由绿叶制药在德国的子公司Luye Pharma公司通过透皮释药技术平台自主研发,为利斯的明创新贴剂剂型。据绿叶制药早先新闻稿介绍,与利斯的明透皮贴剂(单日贴)相比,LY03013具有更低的使用频率,可改善患者的用药依从性;与口服制剂相比,该药物通过穿透皮肤被人体吸收,亦为存在吞咽困难的病患提供了良好的用药便捷性,并有望降低恶心、呕吐等肠胃不良反应的发生率。
信息来源于网络
研究进展
01 Cell I Cas9会导致染色体丢失,诺奖团队开发改进方案,提高基因编辑的临床安全性
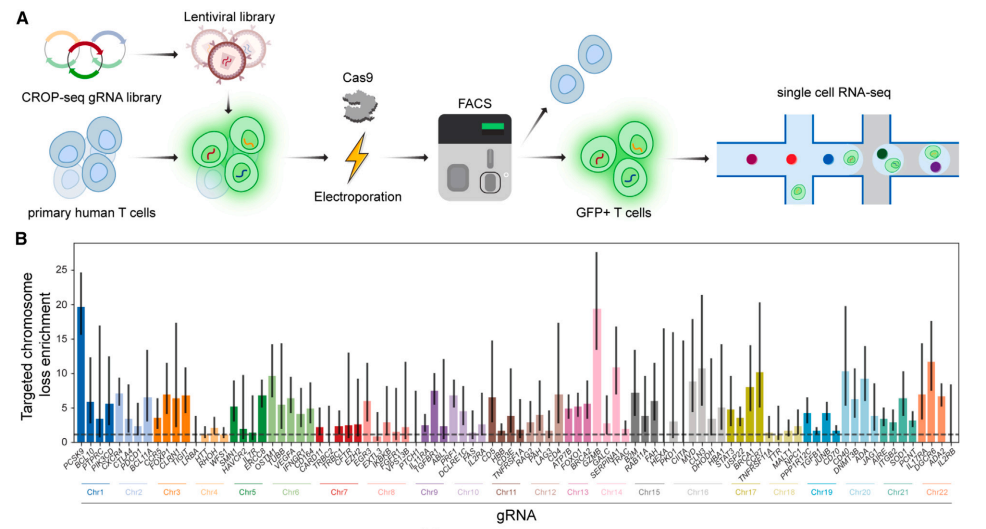
2023年10月3日,诺贝尔化学奖得主、加州大学伯克利分校的 Jennifer Doudna 教授团队在 Cell 期刊发表了题为《Mitigation of chromosome loss in clinical CRISPR-Cas9-engineered T cells》 的研究论文。研究团队在人体临床试验(NCT03399448)中首次采用了一种新的T细胞基因编辑方案,不仅减少了染色体缺失,同时还在很大程度上保留了基因组编辑的效果。改进的方案提高了p53的水平,以保护染色体并避免其缺失。这表明Cas9诱导的染色体缺失很可能是通过产生DNA双链断裂(DSB)进而诱导同源定向修复(HDR)所致。因此,不产生DNA双链断裂(DSB)的基因编辑技术,例如碱基编辑或表观基因编辑,可能会避免染色体缺失。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00975-3
02 Molecular Therapy I 渐冻症AAV基因治疗新方法

近日,上海科技大学生命科学与技术学院罗振革团队在 Molecular Therapy 期刊发表了题为《Intrathecal delivery of AAV-NDNF ameliorates disease progression of ALS mice》的研究论文。研究团队开展了一项关于肌萎缩侧索硬化症(ALS)的基因治疗研究。他们通过脊髓鞘内注射的方式将基因载体AAV-NDNF输送给ALS小鼠模型,结果显示该治疗策略可以显著改善小鼠的运动行为并减缓体重下降,同时也延长了小鼠的生存时间。研究团队还发现该治疗方式可以促进脊髓运动神经元的存活,减少异常蛋白的聚集,保护神经肌肉接头,并减缓肌肉的萎缩。这项研究为ALS的基因治疗提供了新的潜力,但仍需要进一步验证和研究。
原文链接:https://doi.org/10.1016/j.ymthe.2023.09.018
03 Cell Stem Cell I 全球进展最快的癫痫iPSC干细胞疗法,将发作频率减少95%
Neurona Therapeutics于2023年10月5日在Cell Stem Cell杂志上发表了题为《Human pallial MGE-type GABAergic interneuron cell therapy for chronic focal epilepsy》的论文,介绍了一种新型的再生细胞治疗策略,用于治疗耐药性局灶性癫痫。经研究证明,这种名为NRTX-1001的细胞具有稳健性和可重复性,是一种高度纯化的大脑皮层MGE型(内侧神经节隆起)GABA能抑制性中间神经元细胞治疗候选物,源自人类干细胞系。临床前数据表明,在慢性内侧颞叶癫痫动物模型中,将NRTX-1001细胞移植可显著抑制动物的局灶性癫痫发作,减轻神经病理学表型并提高动物生存率。这些临床前研究结果为正在进行的开放标签首次人体I/II期试验(NCT05135091)提供了支持,该试验用于治疗患有耐药性MTLE的成人患者,并已经显示出积极的早期临床数据。两名患者在接受NRTX-1001治疗一年后仍报告总癫痫发作次数减少>95%。
原文链接:https://www.science.org/doi/10.1126/science.adi6412
04 Nature I iPSC类器官组装体携手CRISPR筛选,揭示影响神经发育疾病致病基因
近日,来自斯坦福大学的科研团队在Nature期刊上发表了题为《Assembloid CRISPR screens reveal impact of disease genes in human neurodevelopment》的论文,他们利用升级的大脑类器官组装体模型和CRISPR基因筛选技术,通过对神经发育障碍相关基因的功能分类,揭示了这些基因在抑制性神经元发育中的作用,加快了致病基因的研究进程,为神经发育障碍的药物研发提供了新思路和可能性。同时,这项研究还为自闭症等神经发育性疾病的治疗和预防提供了理论基础,有望带来更好的诊断和治疗方向。
原文链接:https://doi.org/10.1038/s41586-023-06564-w
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容


微信公众号

药方舟手机版


