
2023-11-09 15:11:29来源:国家药品监督管理局浏览量:1802
药品检查合作计划(Pharmaceutical Inspection Co-operation Scheme,PIC/S)旨在通过制定GMP领域的共同标准和向检查员提供培训机会,协调全球的检查程序。
简单来说,他们颁布的药品生产管理规范(GMP)就是国际通行准则和国际检查的金标准。
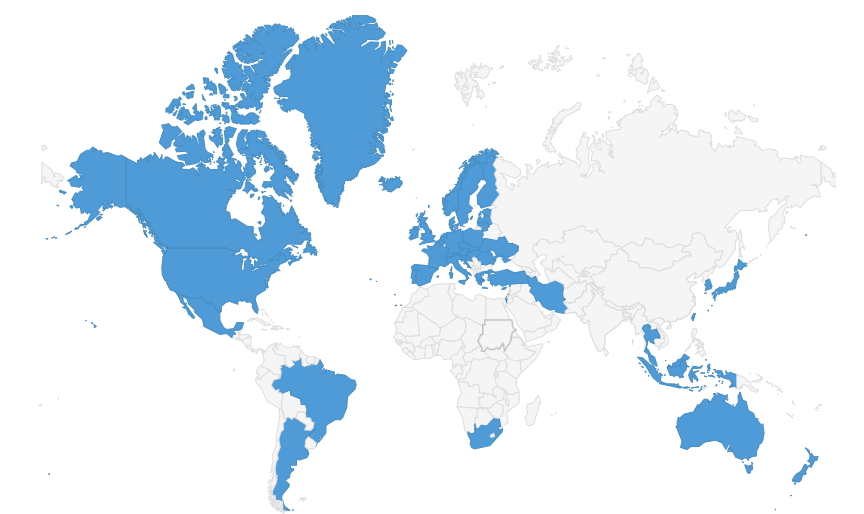
全球分布情况
来源:PIC/S官网
举个例子,药品A在通过一个成员国认证后,其他成员国都会认可这个检查结果(但不意味着就在其他成员国上市)。但GMP认证仅仅是产品在成员国上市的必要条件,具体要看各国各地区的产品注册法规。
目前,我国虽然对药品生产企业实施 GMP 已20 余年,但现行版 GMP 与大多数国家尤其是发达和重要的发展中国家尚未达成互认,这在很大程度上影响了我国药品监管的国际的影响和医药产品进入国际市场的进程。
加入 PIC/S 是实现我国多边 GMP MRAs 、未来中国药品检查与国际接轨的重要路径。
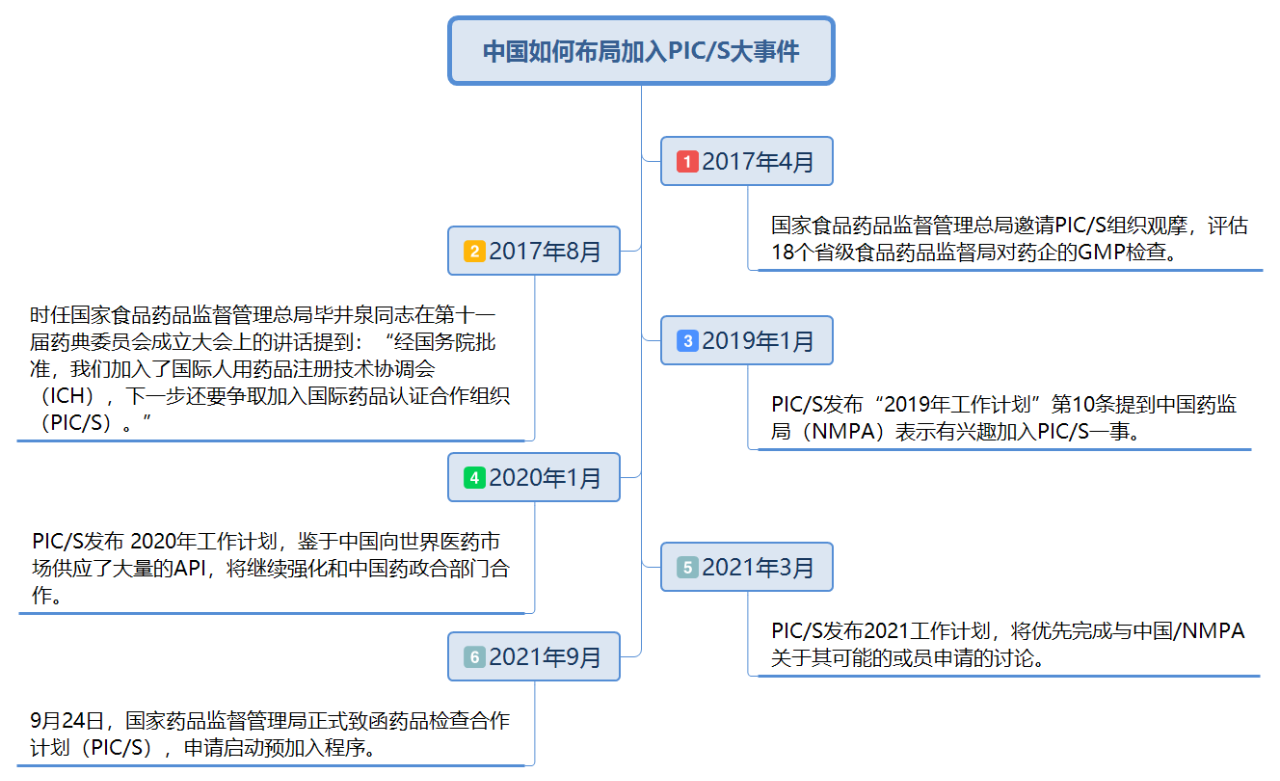
那在此过程中,行业面临洗牌?
从药品优良制造准则的发展历史可以看见,从GMP到cGMP,最终达成 PIC/S GMP,这段过程中,制药标准的提升与法规限制下,符合厂商数相对减少,导致在业界产生“实施 GMP,工厂关一半”的负面印象。
从产业的角度来看,2021年9月,国家药监局就致函PIC/S提出启动加入PIC/S预申请程序,而且在搭配整体背景因素均相对成熟的情况下,不会出现这种厂家数明显下滑的情况。
而且据业内人士所说,当前国内GMP监察已非常严格,面对PIC/S GMP的检查,“实施 GMP,工厂关一半”的负面影响会相对较小。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容