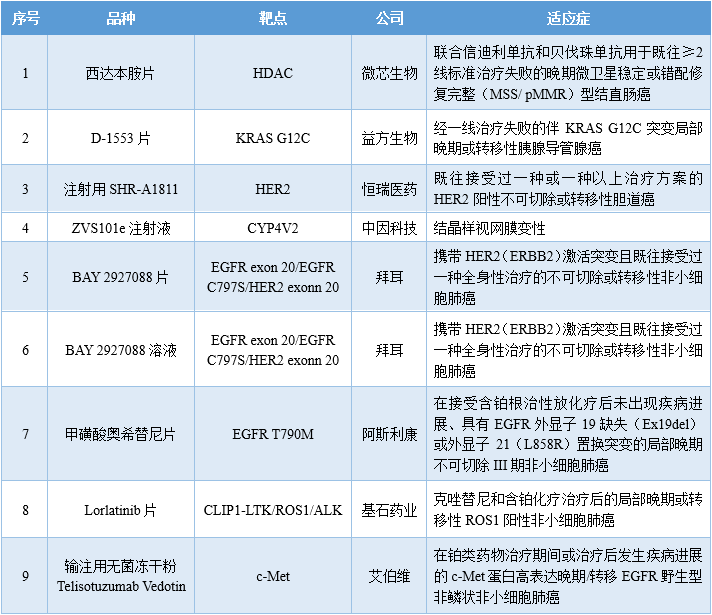
CDE网站显示,9个品种拟纳入突破性疗法。
西达本胺(商品名:爱谱沙/Epidaza)是微芯生物开发的一款组蛋白去乙酰化酶(HDAC)抑制剂,是唯一可通过口服的亚型选择性HDAC抑制剂,其对肿瘤抑制性免疫微环境具有重新激活作用。2014年12月,西达本胺首次在中国获批上市,用于既往至少接受过一次全身化疗的复发或难治的外周T细胞淋巴瘤(PTCL)患者。后来,西达本胺在国内的适应症又扩大至①联合芳香化酶抑制剂用于经内分泌治疗复发或进展的局部晚期或转移性HR+/HER2-绝经后乳腺癌患者和②联合R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和强的松)用于MYC和BCL2表达阳性的既往未经治疗的弥漫大B细胞淋巴瘤(DLBCL)患者。此次西达本胺拟纳入突破性疗法的适应症为联合信迪利单抗和贝伐珠单抗用于既往≥2线标准治疗失败的晚期MSS/pMMR型结直肠癌患者。在II期CAPability-01研究中,25例MSS/pMMR型结直肠癌患者接受该三联疗法治疗后,总缓解率(ORR)为44.0%,中位无进展生存期(mPFS)为7.3个月。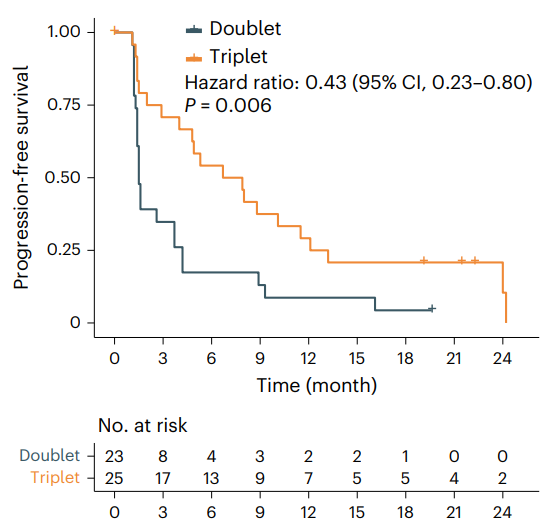
目前,微芯生物的合作伙伴HUYA Bioscience和BMS正在开展西达本胺联合纳武利尤单抗一线治疗黑色素瘤的全球多中心III期临床试验。D-1553(格舒瑞昔)是益方生物开发的一款KRAS G12C抑制剂,也是第二款申报上市的国产KRAS G12C抑制剂。2023年8月,正大天晴与益方生物签订许可与合作协议,获得D-1553产品在中国大陆地区开发、注册、生产和商业化的独家许可权。此次D-1553拟纳入突破性疗法的适应症为经一线治疗失败的伴KRAS G12C突变局部晚期或转移性胰腺导管腺癌患者。I/II期D1553-101研究结果显示,10例晚期胰腺癌患者接受治疗后,客观缓解率(ORR)为50.0%,疾病控制率(DCR)为80%,mPFS为8.54个月。SHR-A1811是恒瑞医药自主研发的一款HER2 ADC,其可通过与HER2表达的肿瘤细胞结合并内吞,在肿瘤细胞溶酶体内通过蛋白酶剪切释放毒素,诱导细胞周期阻滞从而诱导肿瘤细胞凋亡。此次SHR-A1811拟纳入突破性疗法的适应症为既往至少接受过一种治疗方案的HER2+不可切除或转移性胆道癌(BTC)患者。I期研究结果显示,15例BTC患者接受治疗后,ORR为60.0%。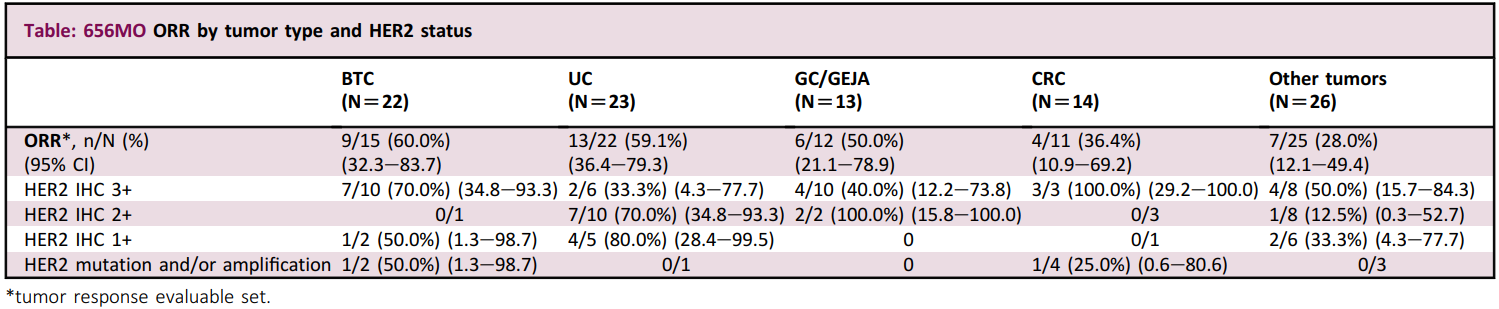
此前,SHR-A1811也多次被纳入突破性疗法,包括①单药治疗既往含铂化疗失败的HER2突变的晚期非小细胞肺癌(NSCLC);②HER2低表达的复发或转移性乳腺癌;③HER2阳性晚期结直肠癌;④HER2阳性复发或转移性乳腺癌;⑤HER2阳性晚期胃癌或胃食管结合部腺癌。ZVS101e是中因科技开发的一款用于治疗结晶样视网膜变性(BCD)的基因疗法,于2021年1月首次进入临床阶段。BCD是一种特殊类型的视网膜变性,典型改变为黄白色闪光结晶样物质沉积于视网膜,伴有视网膜色素上皮细胞和脉络膜毛细血管层萎缩,严重危害视力。BCD是工作年龄人群致盲的重要病因,其全球发病率为1/57600,中国发病率约为1/25000。该疾病目前尚无有效治疗手段。已知80-90%的BCD患者是由CYP4V2基因突变所致,ZVS101e主要通过rAAV病毒将正常的CYP4V2基因拷贝携带到患者视网膜细胞中,补充视网膜细胞中正常CYP4V2基因的表达量,恢复视网膜细胞功能,以达到治疗的目的。此次ZVS101e拟纳入突破性疗法的适应症即为BCD。I期研究结果显示,12例BCD患者接受治疗一年后,最佳矫正视力(BCVA)提高了11个字母。
BAY 2927088是拜耳开发的一款口服可逆酪氨酸激酶抑制剂,于2021年10月首次启动I期临床试验。此次BAY 2927088片和BAY 2927088溶液拟纳入突破性疗法的适应症为携带HER2(ERBB2)激活突变且既往接受过一种全身性治疗的不可切除或转移性NSCLC。I期研究结果显示,69例NSCLC患者接受治疗后,整体ORR为26.0%,其中携带HER2 exon 20突变的人群的ORR为60.0%。奥希替尼是阿斯利康开发的一种不可逆的第三代EGFR-TKI,具有抗CNS转移的临床活性。2015年11月,奥希替尼首次在美国获批上市。截至目前,该药物在美国已获批4项适应症:此次奥希替尼拟纳入突破性疗法的适应症为在接受含铂根治性放化疗后未出现疾病进展、具有Ex19del或外显子21(L858R)置换突变的局部晚期不可切除III期NSCLC患者。在III期LAURA研究中,143例NSCLC患者接受治疗后,PFS达到了39.1个月,疾病进展风险降低了84%。Lorlatinib(洛拉替尼)是辉瑞和基石药业合作开发的一款ROS1/ALK抑制剂,于2018年9月首次在日本获批上市。2022年4月,该药物在中国获批上市,用于治疗ALK阳性的局部晚期或转移性NSCLC患者。此次Lorlatinib拟纳入突破性疗法的适应症为经克唑替尼和含铂化疗治疗后的局部晚期或转移性ROS1阳性NSCLC患者。一项II期研究结果显示,32例ROS1阳性NSCLC患者接受治疗后,ORR为69%,PFS为35.8个月。经治和初诊患者亚组的ORR分别为46%和81%。Telisotuzumab vedotin是艾伯维开发的一款靶向c-Met的first-in-class ADC,由抗c-Met人源化单抗ABT-700通过缬氨酸-瓜氨酸连接子偶联于细胞毒素单甲基澳瑞他汀E(MMAE)构成。此次Telisotuzumab vedotin拟纳入突破性疗法的适应症为在铂类药物治疗期间或治疗后发生疾病进展的c-Met蛋白高表达晚期/转移EGFR野生型非鳞状非NSCLC患者。II期LUMINOSITY研究结果显示,172例NSCLC患者接受治疗后,整体人群的ORR为28.6%,缓解持续时间(DOR)为8.3个月;c-Met中表达和c-Met高表达人群的ORR分别为22.9%和34.6%,DOR分别为7.2个月和9.0个月。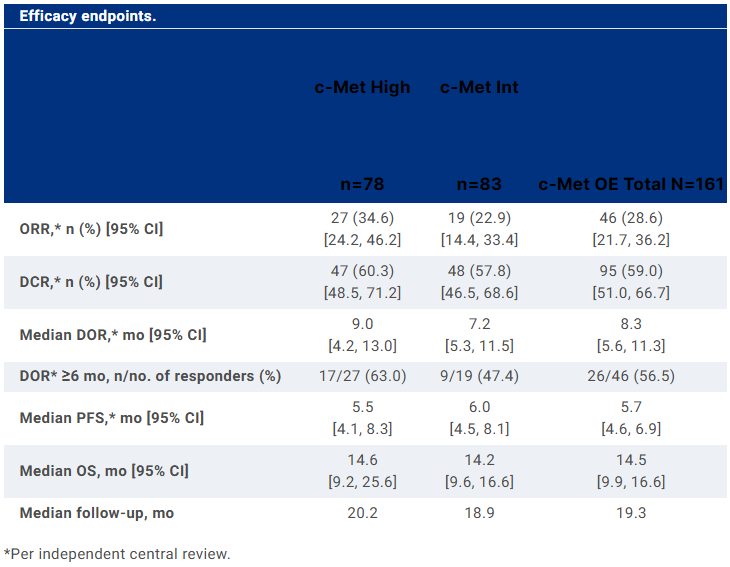 来源:ASCO 2024大会目前,全球尚无c-Met ADC获批上市,而Telisotuzumab vedotin是在研药物中开发进度最快的c-Met ADC。
来源:ASCO 2024大会目前,全球尚无c-Met ADC获批上市,而Telisotuzumab vedotin是在研药物中开发进度最快的c-Met ADC。声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容



 来源:ASCO 2024大会
来源:ASCO 2024大会