一、山东省药品监督管理局
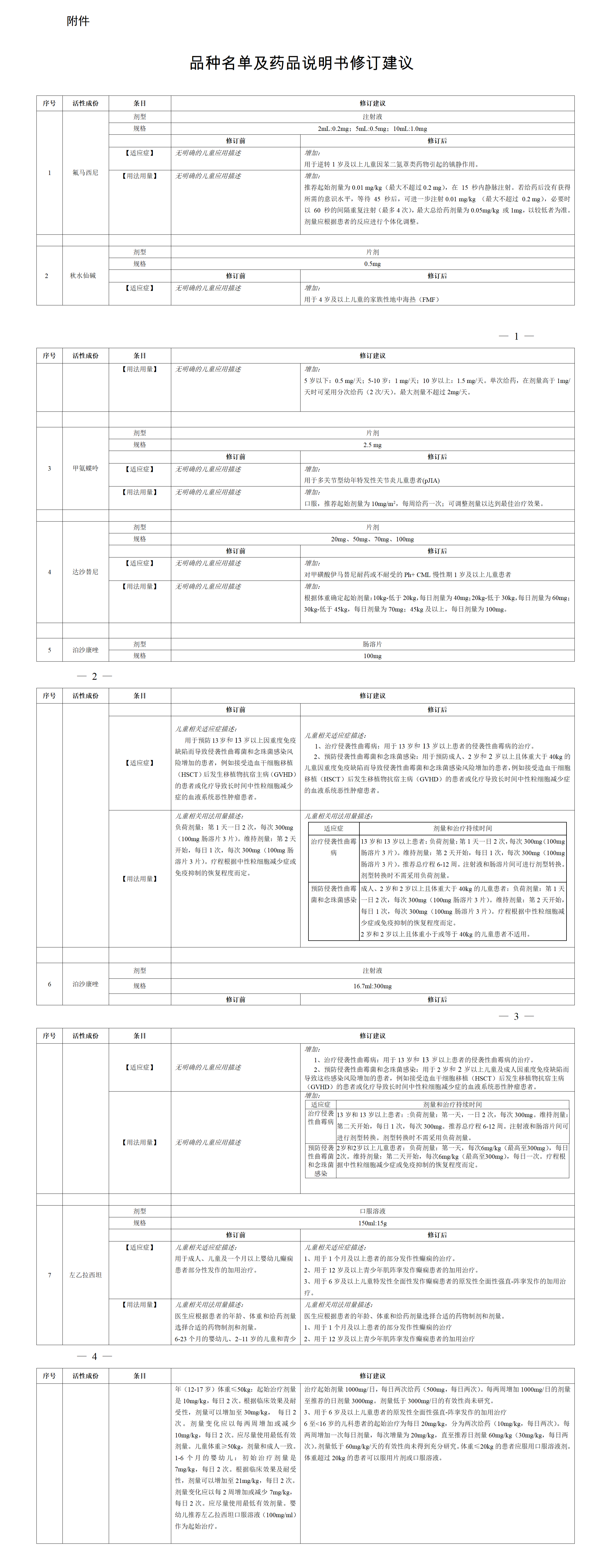
(一)关于公开征求《山东省药品监督管理局药品生产监督检查后处置工作程序》意见建议的通告http://mpa.shandong.gov.cn/art/2024/5/27/art_101797_10389777.html为进一步贯彻落实新修订法律法规要求,规范药品生产监督检查后处置工作,我局研究制定了《山东省药品监督管理局药品生产监督检查后处置工作程序(征求意见稿)》,现向社会公开征求意见。有关单位和公众可依据有关法律法规提出修改意见和建议,于6月28日前反馈我局。邮 箱:ypshengchanchu@shandong.cn。(二)山东省药品监督管理局药品生产监督检查后处置工作程序(征求意见稿)解读http://mpa.shandong.gov.cn/art/2024/5/27/art_101797_10390066.html(一)贯彻落实法律法规要求。《药品管理法》第九十九条规定,对有证据证明可能存在安全隐患的,药品监督管理部门根据监督检查情况,应当采取告诫、约谈、限期整改以及暂停生产、销售、使用、进口等措施,并及时公布检查处理结果。《药品生产监督管理办法》第五十九条规定监督检查发现药品生产管理存在缺陷,有证据证明可能存在安全隐患的,应当依法采取告诫、约谈、限期整改、暂停生产(销售、使用)等措施。制定本程序,是全面落实法律法规要求,及时、有效、规范处置安全隐患,确保药品质量安全的需要。(二)实现检查后处置闭环管理。为贯彻新法律法规要求,夯实企业药品质量安全主体责任,本程序要求被检查单位对药品监督管理部门现场检查发现的所有缺陷项目均应当进行整改。对“限期整改”进行了明确,即药品监督管理部门对有证据证明可能存在安全隐患或药品生产活动偏离质量管理规范、标准的,以及未在规定期限内提交整改报告或计划,或者在复查中发现未如实填报整改报告或整改不到位的被检查单位,依法采取责令改正的风险控制措施,及时消除安全隐患。(三)规范有序实施后处置工作。该程序的制定和实施,进一步明确了省局有关处室、区域检查分局及直属单位在监督检查后处置工作中的工作职责与权限,明确各环节的工作要求和时限,统一了整改、告诫信、约谈记录以及复查报告的文件格式,使后处置工作有序开展、无缝衔接,确保风险在第一时间得到控制,有效落实各方的监管责任。2023年7月,国家药监局印发《关于修订<药品检查管理办法(试行)>部分条款有关事宜的通知》(国药监药管〔2023〕26号)。2023年11月,国家药监局综合司印发《药品生产质量管理规范符合性检查工作程序(试行)》(药监综药管〔2023〕86号)。上述两个文件发布后,药品生产处牵头组织相关处室、分局、单位和企业代表召开专题研讨会,在省局原有工作程序基础上,进行了讨论和修改,2024年4月份形成初稿。5月初,再次召集相关分局、单位和企业代表进行修改研讨。5月中旬,征求各市市场监管局、区域检查分局、相关直属单位意见,形成本征求意见稿。本程序适用于省局直接对药品上市许可持有人、药品生产单位(含原料药、制剂、中药饮片、医用氧、药用辅料、药包材、医疗机构制剂室、中药提取物等)组织开展的药品生产监督检查采取整改、告诫、约谈、限期整改、暂停生产(销售、使用)、依法查处等风险控制措施的工作程序。
1.明确各方职责。程序规定省局药品生产处负责组织实施后处置措施的行政工作。属地日常监管部门负责对辖区内被检查单位组织实施后处置措施和现场复查,受省局委托开展约谈等后处置工作。省食药审评查验中心负责实施监督检查,负责提供检查报告审核意见、出具综合评定结论等技术支撑工作。省食药检院负责监督检查抽样的检验工作。省执法监察局负责组织涉嫌违法案件的查办工作。现场检查实行组长负责制,对检查发现缺陷问题进行如实记录,并根据发现缺陷问题做出客观、公正、准确的检查结论,对现场检查结果负责。2.明确检查结论及综合评定结论的判定标准。本程序将现场检查结论分为符合要求、待整改后评定、不符合要求,明确了现场检查结论的评定标准。综合评定结论分为符合要求、不符合要求,明确了综合评定结论的评判标准。3.明确后处置流程及后处置措施。为实现后处置工作的标准化、规范化和程序化,本程序将后处置流程分为检查报告审核、风险通报、企业整改、整改复查、综合评定、采取后处置措施、检查结果通告、解除暂停生产(销售、使用)风险控制措施。基于风险原则,将后处置措施分为整改、告诫、约谈、限期整改、暂停生产(销售、使用)、依法查处等六种情形。4.明确后处置工作的时限要求。为确保对检查发现的缺陷问题第一时间采取风险控制措施,省食药审评查验中心应在收到现场检查报告15个工作日内,会同省药监局药品生产处进行风险会商,确认现场检查结论,形成检查报告审核意见。检查结论为待整改后评定的,属地日常监管部门应当在收到整改报告后10个工作日内开展现场复查并出具复查报告。对现场检查结论为待整改后评定的,省食药审评查验中心对现场检查报告、整改报告、复查报告等进行技术审核,自收到整改报告、复查报告20个工作日内完成。5.统一文书模式。按照合法合规、统一规范、便捷高效的原则,制定了工作流程图、整改告知书、告诫信、约谈记录、复查报告、综合评定报告、暂停生产(销售、使用)药品风险控制措施通知书、同意解除暂停生产(销售、使用)风险控制措施的通知的文件格式及内容,有利于全省各级监管部门及药品上市许可持有人及生产单位执行,防止出现全省同一事项文件格式内容不一致情形。(三)关于公开征求《山东省药品监督管理局关于进一步做好药品经营监督管理有关工作的通告(征求意见稿)》意见的通知http://mpa.shandong.gov.cn/art/2024/5/30/art_101797_10390067.html为贯彻落实《药品经营和使用质量监督管理办法》(国家市场监督管理总局令第84号)和国家药监局《关于进一步做好药品经营监督管理有关工作的公告》(2024年第48号)相关要求,进一步加强全省药品经营监督管理,规范药品经营行为,保障药品经营环节质量安全,结合我省实际,我局起草了《山东省药品监督管理局关于进一步做好药品经营监督管理有关工作的通告(征求意见稿)》,现公开征求意见。请填写征求意见反馈表(附件3),于2024年6月30日前反馈至电子邮箱ypscc@shandong.cn,邮件主题请注明“进一步做好药品经营监督管理有关工作通告的意见反馈”。 附件:1. 山东省药品监督管理局关于进一步做好药品经营监督管理有关工作的通告(征求意见稿) 2.山东省药品监督管理局关于进一步做好药品经营监督管理有关工作的通告(征求意见稿)起草说明 3. 山东省药品监督管理局关于进一步做好药品经营监督管理有关工作的通告(征求意见稿)反馈表二、北京市药品监督管理局
(一)关于对《北京市推动药品出口工作方案(征求意见稿)》公开征求意见的公告
网址:https://yjj.beijing.gov.cn/yjj/zwhd17/zjdc38/436460079/index.html
为落实《北京市支持创新医药高质量发展若干措施(2024)》的要求,鼓励我市医药产业对标国际先进水平,激发我市企业参与国际市场竞争的积极性,推动药品出口,北京市药品监督管理局、北京市商务局、北京海关共同制定了《北京市推动药品出口工作方案(征求意见稿)》,现向社会公开征求意见,欢迎社会各界提出意见建议。
公开征集意见时间为:2024年5月30日至2024年6月5日。
意见反馈渠道如下:
1.电子邮箱:ypscjgc@yjj.beijing.gov.cn,邮件主题请注明“北京市推动药品出口工作方案意见反馈”
2.通讯地址:北京市通州区留庄路6号院2号楼北京市药品监督管理局药品生产处(请在信封上注明“意见征集”字样)
3.电话:010-55526919
4.传真:010-55526919
5.登陆北京市人民政府网站(http://www.beijing.gov.cn),在“政民互动”版块下“政策性文件意见征集”专栏中提出意见。
附件:
1. 《北京市推动药品出口工作方案(征求意见稿)》
2. 《北京市推动药品出口工作方案(征求意见稿)》起草说明
3. 《征求意见反馈表》
北京市药品监督管理局
2024年5月30日

(二)北京市药品监督管理局新增问题
Q1、已上市化学药品说明书及包装标签有多个微小变更,是否需要将新版说明书及包装标签备案?
问:我公司需要对已上市产品的说明书和包装标签进行如下变更:1,说明书和包装标签上的持有人和生产企业联系电话变更,并增加企业网址;2,包装标签上的监管码,商品条码印刷位置互换;3,包装盒上的“有效期”字样,按照《药品说明书和标签管理规定(局令第24号)》要求,修改为”有效期至“; 按照2021年发布的《已上市化学药品和生物制品临床变更技术指导原则》,不会改变药品使用安全性和有效性信息的变更应属于微小变更。我司评估上述变更均属于微小变更。但由于变更内容较多,导致新版说明书和包装标签与已备案版本明显不同。请问,我司是否需要将新版说明书和包装标签的模板通过申请中等变更,进行备案?
答:网民您好!关于您咨询的问题,经核实回复如下:根据我国现行药品上市后变更管理相关要求,微小变更应当在年度报告中报告。北京市药品监督管理局 2024年5月29日
Q2、关于药品生产企业小包装设计稿与国家药监局核准小盒不一致问题?
问:药品生产企业小包装设计稿与国家局备案小盒样式、内容不符。以“用法用量”为例,设计稿为“片剂为口服给予。其他详见说明书”,国家局备案小盒为“口服。成年人(包括老年人):首次剂量为每日400mg,分次服用。当疗效不再进一步改善时,剂量可减至200mg维持。儿童:应使用最小有效剂量。具体用法用量及注意事项详见说明书”。 这种情况是否可按《药品说明书和标签管理规定》第十八条“.........适应症或者功能主治、用法用量、不良反应、禁忌、注意事项不能全部注明的,应当标出主要内容并注明’详见说明书’”,理解为,药品生产企业小包装设计稿的“用法用量”不能全部列明,就可以写为“片剂为口服给予。其他详见说明书”(国家药监局核准的说明书“用法用量”第一句话为“片剂为口服给予”,所以是以说明书为依据),而不必完全遵循国家局备案小盒的内容和样式?只要符合说明书内容即可?
答:网民您好!关于您咨询的问题,经核实回复如下:请严格按照该品批准注册时批准证明性文件所附说明书及包装标签执行。北京市药品监督管理局 2024年5月30日
Q3、关于咨询主要研究者参加过3个以上试验的定义问题
问:2020年06月05日发布的《市药监市卫健委联合出台实施意见进一步加强药物临床试验机构管理的实施意见》中主要研究者应当具有高级职称并参加过3个以上经国家药品监管部门批准或备案的药物临床试验。想咨询一下,3个试验是否限定已结题完成,或参与了正在开展的临床试验也符合要求。
答:网民您好!关于您咨询的问题,经核实回复如下:根据《药物临床试验机构管理规定》第五条规定,备案的主要研究者应当参加过3个以上药物临床试验。“参加过3个以上药物临床试验”应为3个以药品注册为目的、已完成的药物临床试验项目。北京市药品监督管理局 2024年5月31日