
2024-07-29 12:00:29来源: QA and MAH部落浏览量:2828
关键网传的这个飞行检查缺陷汇总,据说是省局2024年即今年进行汇总的缺陷,从微信群还有注明公众号平台都有看到分享,本身飞行检查缺陷汇总不稀奇,但是这次飞行检查汇总的缺陷感觉被之前的其他缺陷严了很多,有些缺陷感觉都是平时很多药企都会存在的缺陷,也是作为严重缺陷落下,只能说现在监管部门对企业的质量管理要求越来越严格,对于很多A证企业,C证企业人员配备一般比较充足,可能还好点,但是对于很多B证企业,本身人员配备可能就不是那么充足,又加上人员对质量管理体系运行存在盲点,对工艺也不是那么熟悉,所以在委托生产监管过程中,可能会存在很多疏漏,至少与A,C证相比可能会存在一些欠缺,咱们一起看下,都有哪些缺陷:
1.1《胞磷胆碱钠注射液工艺验证报告》,对生产批量由10万支增至15万支进行验证,未对产品在水浴灭菌器中的装载数量及装载方式进行确认。【分析:未对工艺验证产品在水浴灭菌器中的装载数量及装载方式进行确认,这样也是严重缺陷,装载数量与装载方式确实会影响灭菌的效果,工艺验证过程未没有考虑到灭菌的效果,落严重缺陷确实也是说的通的,不过这个也确实是看检查老师个人的,监管趋严,工艺验证需要考虑的全面】
1.2《胞磷胆碱钠注射液工艺时限验证报告》,仅对存放0、8、10、12小时的产品进行无菌检测,未对有关物质等质量指标进行考察。【分析:工艺严重问题:《胞磷胆碱钠注射液工艺时限验证报告》,仅对存放0、8、10、12小时的产品进行无菌检测,未对有关物质等质量指标进行考察。这一条个人感觉应该很多企业都会遇到,工艺验证时限检测项目不全,很多企业是跟进自己的风险评估进行的检验项目的确认,这一条缺少有关物质等质量指标考察,也作为严重缺陷,说明现在药监部门监管还是非常严格的,有可能是针对这个产品,储存时限对有关物质的影响比较大】
2、质量控制检验存在问题:
2.1 胞磷胆碱钠注射液质量标准【含量测定】项下要求进样量为10μl,实际操作进样量为20μl,企业未启动偏差调查,而是将原始检验记录中高效液相色谱图的进样量手工修改为10μl,且企业审核过程没有发现该问题。【分析:这一条落严重缺陷真的是一点不冤枉,这是数据真实性的问题,是一条红线,如果按照前段时间,四川同创康能药业有限公司,因检验人员批检验记录鉴别造假,检验人员与质量负责人皆被罚款,禁业,那这一条深究的话,也是一样的,可以罚款加禁业的,四川同创罚款禁业文章链接(“飞来横祸”:检验记录造假,质量负责人、检验人员全都罚款,禁业!!)】
2.2 胞磷胆碱钠含量测定的原始检验记录中,高效液相色谱图无进样时间、操作人等信息。【分析:原始记录无法追溯,这样的情况可能性有很多,有可能是造假,有可能原始数据丢失,也有可能只是纸质图谱中没有进样时间操作人,电子数据里是有的,若是前两种情况,对于药企来说是不应该的,若是最后一种情况,那也不会是严重缺陷,所以这一条是严重缺陷,那大概率就是造假,跟前一条差不多,也是可以罚款,禁业的,这样想想,质量受权人是真的高危职业,检验人员大部分情况下,都是身不由己,一般检验人员都不愿意造假的,检验人员受制于QC经理,QC经理受制于质量负责人,质量负责人受制于老板,所以最终企业的质量文件或者诚信文件咋样,还是得看企业负责人的态度】
2.3 胞磷胆碱钠注射液采用高效液相色谱法进行含量测定、有关物质考察,未按《中国药典》要求进行系统适用性试验。【分析:个人感觉这一条,从字面意思来看,不至于严重缺陷的,但是既然落了严重缺陷,应该是有其原因的,可能与前两条是连在一起的,不过系统适用性试验没有做,或者未按照药典要求做,这个正常情况是不应该的,这是对于HPLC检验人员来说是常识,责任人还是在QC经理或质量负责人,检验人员一般不会自作主张去不按要求进行系统适用性,可能SOP这么规定,或者QC经理要求这么做,即使QC检验人员,真的做的不符合要求,QC经理、QA,质量负责人也应该有人能审核出来,所以质量部门领导需要负责任】
2.4 质量控制部采用进口胞磷胆碱钠标准物质“作为药品检验对照品,用于原料胞磷胆碱钠及胞磷胆碱钠注射液12个月持续稳定性考察。未将该进口标准物质与法定对照品进行比对标化即投入使用。【分析:其实这一条,单独来看的话,也不至于是严重缺陷,稳定性考察用的进口对照品,一般国内检验老师对FDA或EMA的对照品也是认可的,即使用的进口对照品不是官方的,但是也不至于落严重缺陷,而且还是稳定性考察的检验,怎么就因为未与法定标准品进行对比就落严重缺陷,单纯这一条,不至于,可能还是跟上一条一样,是这几天合并到一起的,所以严重缺陷】
3、质量管理体系不能有效运行:
3.1 公司质量管理人员不足;3.2 未对厂房设施进行变更控制。如新建阴凉成品库、将原阴凉成品库改为试剂库、将原常温成品库改为粗品库、在液体库中存放固体物料和建筑材料等均未进行变更控制。3.3 未进行产品质量回顾分析。【分析:这三条还是一起看吧,单独看落的缺陷不至于是严重缺陷,整个大标题是质量体系不能有效运行,这个大标题肯定是可以落严重缺陷的,3.1具体的质量管理人员不足,单看不至于严重缺陷,3.2未对厂房设施进行变更控制,但看也不至于严重缺陷,不过如果全部未进行变更控制,严重缺陷也正常,单独一个,或两个未进行变更控制,不至于严重缺陷,3.3未进行产品质量回顾分析,这条也一样,单独看的不至于严重缺陷,但是这些加一起,让检查老师觉得质量体系不能正常运行,那老师就可能怀疑其他的质量体系运行方面也不符合要求,所以落了严重缺陷】
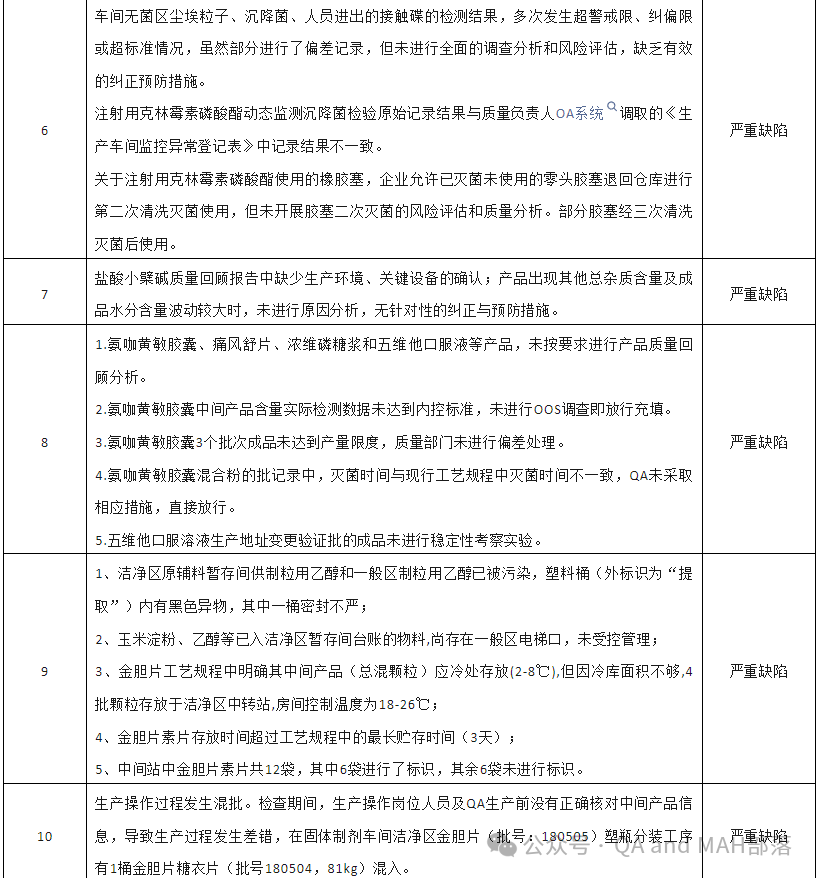
6.1 车间无菌区尘埃粒子、沉降菌、人员进出的接触碟的检测结果,多次发生超警戒限、纠偏限或超标准情况,虽然部分进行了偏差记录,但未进行全面的调查分析和风险评估,缺乏有效的纠正预防措施。【分析:这一条是很多企业比较常见的情况,出现了偏差,也进行了偏差调查,但是未进行完全调查,CAPA自然也是为了CAPA而CAPA,个人感觉这样的情况是偶尔一次还是情有可原,但是若是很多偏差都是这样的情况,那就是故意的,那就明知故犯,严重缺陷应该的】
6.2 注射用克林霉素磷酸酯动态监测沉降菌检验原始记录结果与质量负责人OA系统“调职的《生产车间监控异常登记表》中记录结果不一致。【分析:这可能涉及真实性问题,所以严重缺陷,也不冤枉】
6.3 关于注射用克林霉素磷酸酯使用的橡胶塞,企业允许已灭菌未使用的零头胶塞退回仓库进行第二次清洗灭菌使用,但未开展胶塞二次灭菌的风险评估和质量分析。部分胶塞经三次清洗灭菌后使用。【分析:重复灭菌还是需要评估其风险和质量分析的,毕竟是无菌注射液的关键包材,可能灭菌会影响其质量的,也可能影响其包材相容性的】
8.1 氨咖黄敏胶囊、痛风舒片、浓维磷糖浆和五维他口服液等产品,未按要求进行产品质量回顾分析。8.2 氨咖黄敏胶囊中间产品含量实际检测数据未达到内控标准,未进行00s调查即放行充填。8.3 氢咖黄敏胶囊3个批次成品未达到产量限度,质量部门未进行偏差处理。8.4 氢咖黄敏胶囊混合粉的批记录中,灭菌时间与现行工艺规程中灭菌时间不一致,QA未采取相应措施,直接放行。8.5 五维他口服溶液生产地址变更验证批的成品未进行稳定性考察实验。【分析:第八条还是得连在一起看,有的单独一小条,不至于严重缺陷,但是合并到一起严重缺陷就正常了,8.1产品质量回顾分析药企必做的一件事,居然四个产品都未做,QA人员在干嘛,质量负责人在干嘛,这些产品未做质量回顾分析,都不管不顾?8.2中控未不合规,还未做调查,真的不知道QA与QC都怎么想的,质量负责人肯定知道,知道了还不做调查,那就等着背锅吧,8.3这一条与8.2一样,质量负责人需要负责;8.4批记录与现行工艺规程不一致,严重缺陷不冤枉,且出现了不一致,QA还未采取措施,还直接放行了,那严重缺陷,算是轻的,直接pass都没得说,这肯定是质量负责人需要负责的,8.5场地变更未进行稳定性考察,你能相信?变更前后质量可比性怎么比较?想不通,这质量负责人在干嘛,这个事情都不做】
9.1 洁净区原辅料暂存间供制粒用乙醇和一般区制粒用乙醇已被污染,塑料桶(外标识为“提取”)内有黑色异物,其中一桶密封不严;【分析:洁净区原辅料暂存间的管理缺失,等于没有管理,车间的负责人能不知道吗?现场QA从未检查过?车间洁净区管理人员都干嘛,有一个人较真起来,也不会出现这样的情况,还是说这些人都知道,只是不管不管,都怀着侥幸心理,所以严重缺陷活该】
9.2 玉米淀粉、乙醇等已入洁净区暂存间台账的物料,尚存在一般区电梯口,未受控管理;【分析:同上一条】
9.3 金胆片工艺规程中明确其中间产品(总混颗粒)应冷处存放(2-8℃),但因冷库面积不够,4批颗粒存放于洁净区中转站,房间控制温度为18-26℃;【分析:这个是明星的明知故犯,存储温度相差这么多,也敢放,若是18-26℃经过风险评估或做过验证也对中间产品质量没有影响的话,那直接变更就好了,不能因为放不下就不管质量了,严重缺陷是自找的】
9.4 金胆片素片存放时间超过工艺规程中的最长贮存时间(3天);【分析:这个正常情况,超过多久,进行风险评估,看看超过了最长储存时间,是否对产品质量有影响,若是无影响,或者有实验数据证实,那超过贮存时间也可以解释,或者直接做变更,但是一般老师看到未按照工艺规程进行生产的,又没有合理解释的,肯定是严重缺陷】
9.5 中间站中金胆片素片共12袋,其中6袋进行了标识,其余6袋未进行标识。【分析:这是妥妥的管理问题,没啥好说的】
11.1 工艺再验证产品未进行质量评估和稳定性考察,企业整改仅对相关人员进行了《留样管理规程》和《产品持续稳定性考察管理规程》的培训和考核。解郁安神颗粒原批量为10万袋企业进行了工艺再验证,变更批量为20万袋。上述三批产品未进行质量评估和稳定性考察不足以支持进行批量变更。【分析:这产品都是上市这么久了,这些低级错误还能犯,工艺再严重还不进行质量评估和稳定性考察,产品批量变更都不进行质量评估,也不进行稳定性考察,这研发企业都不敢这么做的吧,产品上市了,还能这么随便,想怎么干就怎么 干,质量负责人在干嘛,公司有质量体系吗?真的让怀疑公司没有质量负责人,没有质量体系一样】
11.2 未对解郁安神颗粒干膏粉的贮存时限(企业规定贮存期6个月,复验后可再贮存6个月)进行验证。企业整改仅对历史检验记录数据的水分、微生物进行回顾分析,未制定干粉贮有时限验证方案进一步对干音粉有效指标(如含量)进行考察。【分析:同上】
13.1 现场检查时,注射用盐酸头孢甲肟的包装工序未监测光照强度、温度等产品影响因素。批记录显示注射用盐酸头孢甲肟(规格:1.0g)分装、轧盖操作结束时,未记录温、湿度。【分析:既然已经知道光照强度与温度对产品影响,批记录又不记录,这是自作孽不可活,这是低级错误,不应该犯的错误】
13.2 盐酸头孢甲肟与无水碳酸钠混合验证时,仅提供了两批产品的验证数据,且无不同时间、不同取样点的描述,对数据分析不全面。【分析:这三批工艺验证,只能提供两批验证数据,这是也是够无语的,难道只做了两批?这也就罢了,不同时间,不同取样点还没有描述,这工艺验证是怎么进行的,生产负责人,质量负责人这些都没有看的吗?犯这样的错误?不应该】
13.3 注射用水日常记录的数据与仪器监测的数据出现偏离未及时调查原因。【分析:这一条单独看,不至于严重缺陷的,不过毕竟是注射用水,出现偏离还是需要调查原因的,注射用水关乎产品安全性的】
13.4 盐酸头孢甲肟采用西林瓶包装留样,与市售包装不一致,也未采用模拟包装。【分析:这是什么操作,留样保证与市售包装不一致,还留样做什么,不懂啥情况,难道这个药非常贵,舍不不得留样?也不至于吧】
13.5 企业变更管理台账中,对变更原辅料供应商等重要变更等级均评定为中度变更,与制定的变更管理规程不一致。【分析:这一条感觉有点奇怪,变更原辅料供应商可以评估为中度变更的,这与制定的变更管理规程不一致,是什么情况,SOP中写的是重大变更?做变更评估都不按照SOP规定进行,这是什么骚操作的,有点看不懂】
13.6 培训检验员使用了一瓶注射用盐酸头孢甲肟,无取样记录。【分析:低级错误】
13.7 质量部的个别取样员未经取样相关培训;碳酸钠含量检测原始记录无计算公式,直接由电脑计算,无法体现修约规则,易产生误差。【分析:低级错误,不应该犯这样的错误,经常发生,那就是质量管理体系有问题,不能正常运行】
13.8 部分检验项目原始记录未代入滴定液校正值进行计算,例如低硼硅玻璃管制注射剂瓶内表面耐水性检测未将0.01mol/L的盐酸滴定液校正值代入计算。【分析:低级错误】



声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容