抗体偶联药物 (ADC) 将抗体的特异性和长体内循环时间,与化学细胞抑制剂或其他活性药物的毒性结合起来,使用适当的化学接头来降低全身毒性并增加治疗指数。这种大分子和小分子的组合增加了复杂性。需要多个生产过程来生产天然抗体,药物和接头,然后偶联形成最终的抗体-药物偶联物。
上述各组分偶联的过程增加了控制点的数量,使得在产品开发生命周期中需要额外的规范和强化的分析表征。分享一篇诺华等多家药企联合发表的文章,阐述从CMC监管角度对ADC药物的考量。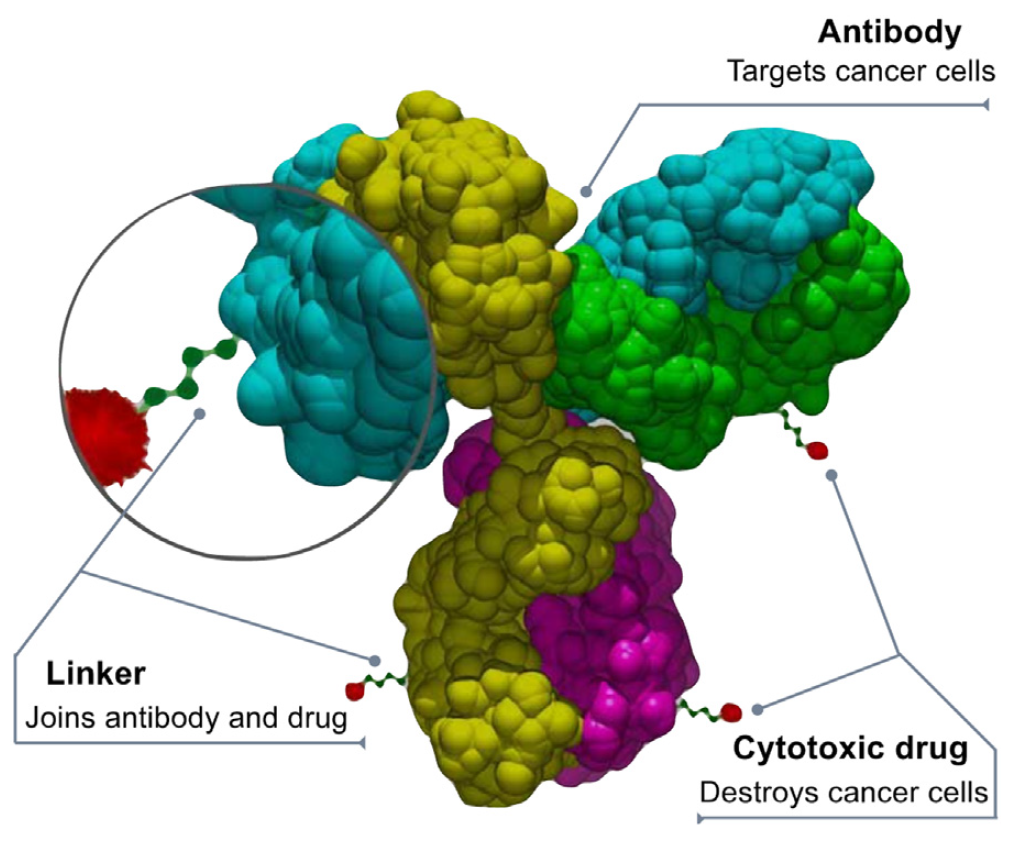
关于ADC工艺变更的考虑
与其他生物分子一样,ADC的制造工艺在开发或上市后也会发生变化,因为人们期望提高稳健性或简化工艺,更改或增加制造商,扩大规模,提高产品质量或稳定性,或适应不断变化的监管期望。ADC整体制造工艺的复杂性在确定如何充分应对变更的影响时带来了额外的挑战。ADC开发商有责任评估工艺变更是否会对ADC产品的安全性和有效性产生负面影响。本节详细介绍了中间体,DS (原料药) 和DP (制剂) 工艺变更的注意事项。
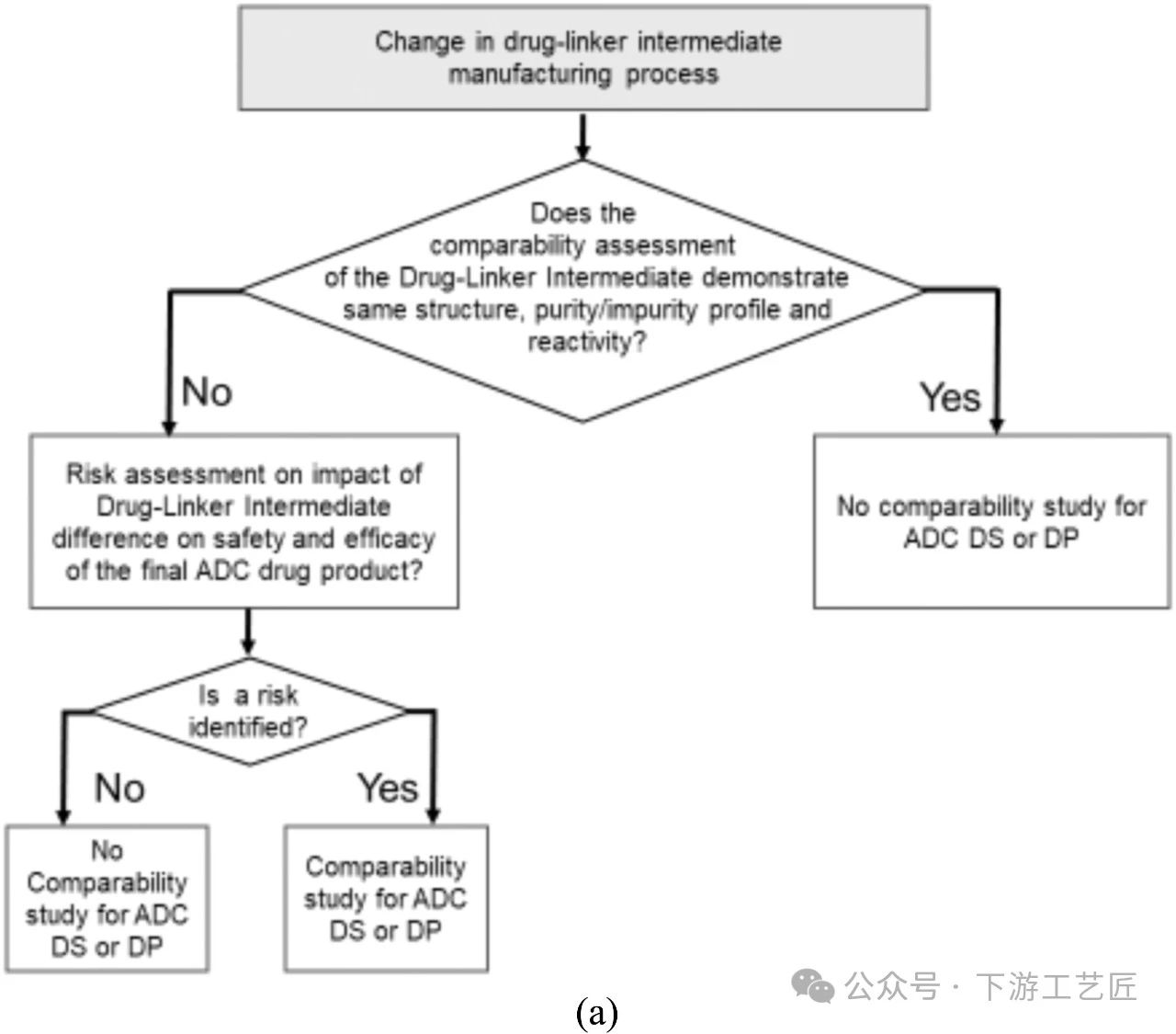
风险分析:药物,连接子和药物连接子中间体是小分子,这意味着它们的特征非常明显,通常有全面的分析方法来证明结构,纯度和杂质概况的一致性。药物连接子生产和放行过程中的检查点通常为控制影响ADC的杂质提供了最佳机会。在典型的ADC偶联工艺中,偶联反应后会进行UF/DF以去除源自药物连接子中间体的试剂,溶剂和其他低分子量杂质。在某些ADC工艺中还会使用色谱步骤去除小分子杂质。因此在药物连接子生产工艺中,通常可以充分控制由药物连接子生产工艺的变化导致的未偶联杂质对最终ADC DS和DP产生的风险。工艺变更后的可比性评估决策树 (图9A):如果对药物连接子中间体的分析评估表明,在工艺变化之前和之后,药物连接子中间体具有相同的结构、可比的纯度分布和反应活性,则该评估通常不需要对衍生的ADC DS或DP进行可比性研究。如果发现纯度/杂质概况存在显著差异,建议进行风险评估,以评估这种差异对最终ADC药物产品的安全性和有效性的影响,并应注意与药物连接子的预期用途保持一致,而不是基于对ADC DS或DP的期望。关于是否要求对新杂质进行鉴定的决定应侧重于DS和DP中杂质水平带来的风险,可参照上文:文献分享:从CMC监管角度对ADC药物的考量 Part I。
图 9A. 药物,连接子或药物连接子中间体工艺变化的可比性评估决策树
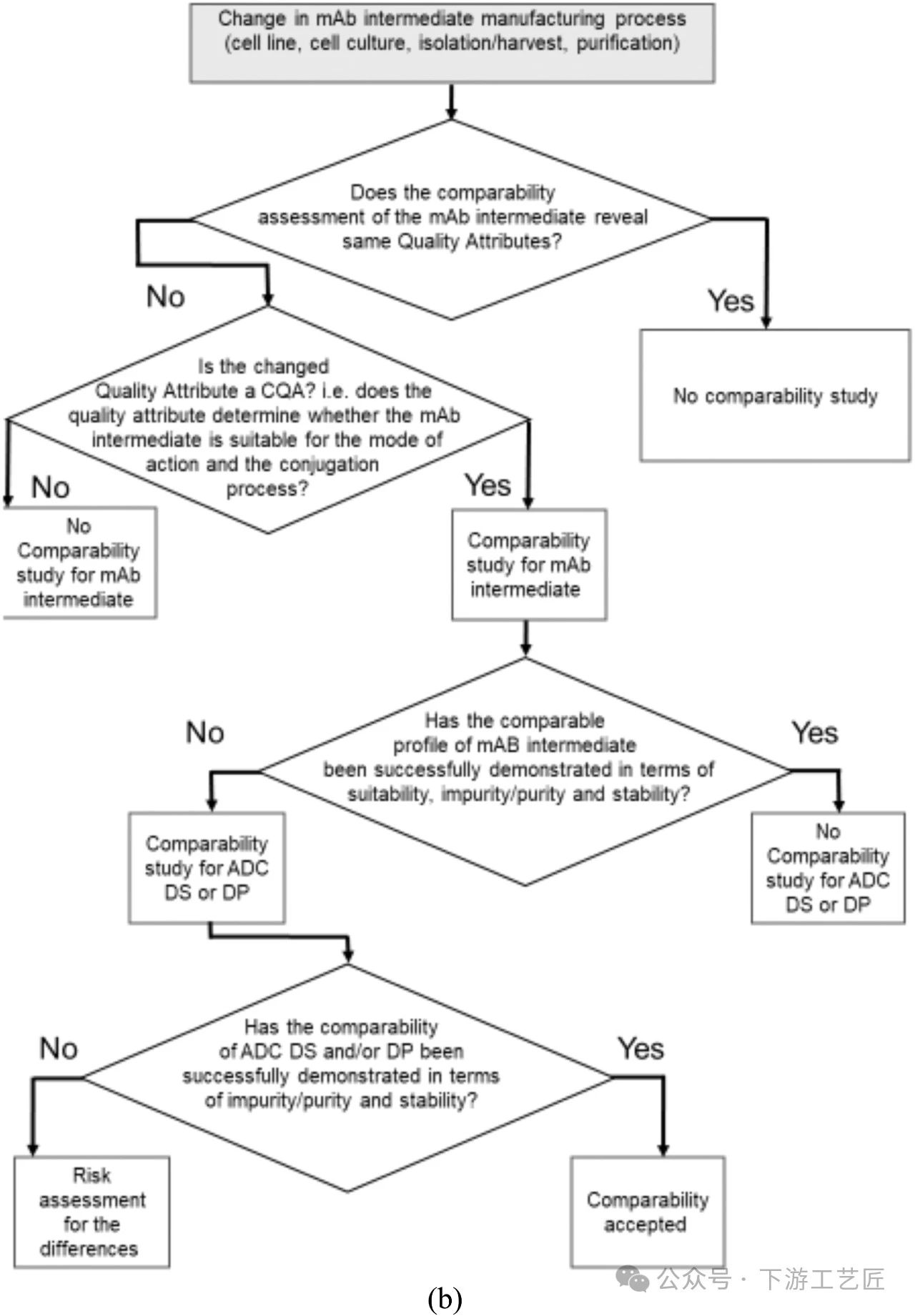
mAb中间体是一种大分子,其质量属性的完整分析本身就更加复杂。随着先进分析工具的发展,表征mAb中间体结构和监测关键质量属性 (CQA) 的能力已经变得更加成熟。然而仍然存在一些风险,如所使用的分析工具可能不够灵敏,无法检测到可能影响最终ADC产品安全性和有效性的所有质量属性。- 评估重点:应评估mAb中间体的细胞系,细胞培养,纯化或分离过程中的工艺变化。与任何mAb药物一样,mAb中间体在mAb水平上控制的质量属性也应在ADC中保持控制,如糖基化,外来病毒和宿主细胞蛋白等。另外,确定mAb中间体是否适合反应和偶联过程的质量属性 (如靶标结合和参与偶联的正确氨基酸) 应在mAb生产过程中进行测试,并且可能需要进行可比性测试。
- 工艺变更后的可比性评估决策树 (图9B):如果在mAb中间体阶段进行的可比性研究成功证明了工艺变更后纯度、杂质和稳定性方面的可比性,则无需在DS和DP阶段采取进一步行动,因为质量已得到充分保证,无需在DS或DP中再次证明。如果无法确定mAb中间体的可比性,但已成功证明DS和/或DP的可比性,则建议对mAb中间体的差异进行风险评估。另外,不会对后续偶联过程或ADC DS的CQA产生不利影响的非关键质量属性的差异并不妨碍对mAb中间体进行工艺变更。
案例分析:mAb中间体中工程化半胱氨酸位点的半胱氨酸化和谷胱甘肽化通常不是CQA,先验知识表明在偶联过程之前的还原步骤中半胱氨酸化和谷胱甘肽化会被完全去除,并且不会影响偶联过程和最终DS的质量,因此半胱氨酸化和谷胱甘肽化作为翻译后修饰的比例差异并不妨碍对mAb中间体工艺进行变更。相反的例子是,翻译后修饰的进一步差异如mAb中间体中赖氨酸的糖基化,也可能影响赖氨酸偶联ADC的药物定位特征,这反过来可能对ADC的体外和体内稳定性产生影响,因此用于赖氨酸偶联ADC的mAb中间体中赖氨酸修饰的显著差异值得在ADC-DS和ADC-DP水平上进行可比性研究。
图 9B. mAb 中间体的工艺变化的可比性评估决策树
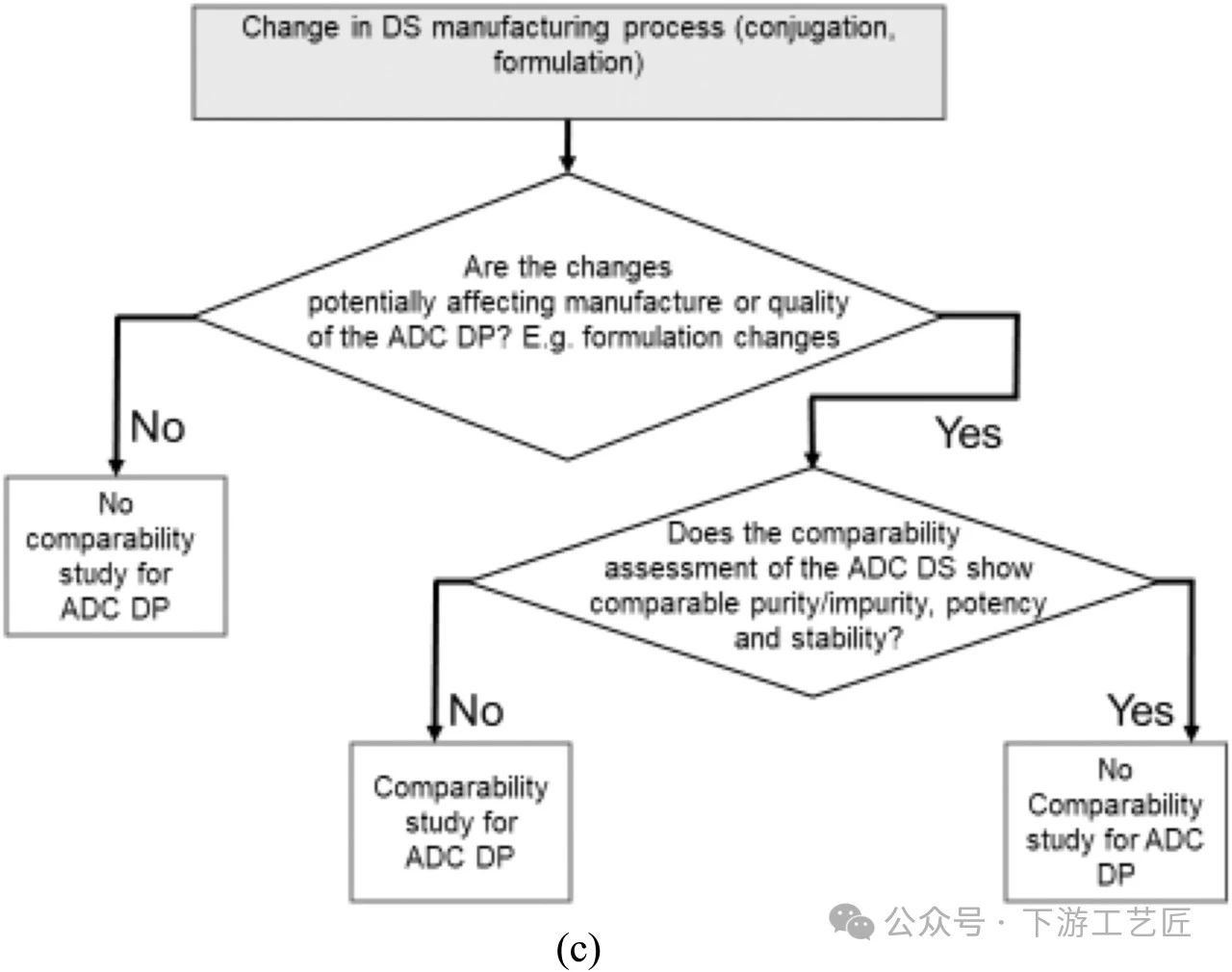
偶联工艺的目的是从中间体生产ADC,去除杂质并制备DS。先进的分析工具被用于检测组合分子的质量特性 (如DAR值)。- 工艺变更后的可比性评估决策树 (图9C):ADC制造工艺 (偶联工艺和DS处方) 的变更应与其他大分子产品的变更处理类似。一般建议仅在ADC DS级别基于风险评估进行可比性研究,以证明工艺变更前后ADC DS的纯度、杂质、效力、稳定性和安全性具有可比性。可能证明可比性实验评估合理的变更包括处方变更、偶联反应缓冲基质的变更、制造地点或规模的变更。但是,如果工艺变更导致DS不可比,或者变更可能影响DP的制造或质量,则应考虑在DP进行额外的可比性评估。
案例分析:例如,如果DS的处方 (pH, 糖, 浓度) 发生变化,则可能需要在DS和DP层面进行可比性研究。例如,如果DS是冷冻液体,而DP是冻干小瓶,那么DS的稳定性就不能直接从ADC DP的稳定性研究中得出。
图 9C. ADC DS的偶联和DS处方工艺变化的可比性评估决策树
与其他大分子药品类似,对于ADC DP的任何工艺变更,在DP阶段都可能需要进行风险评估、可比性研究或前瞻性稳定性研究,以评估对药品纯度、功效和稳定性的影响。例如,对液体DP的填充量进行微调或对瓶塞涂层材料进行微调。
表2总结了为mAb中间体、药物连接子中间体、DS和DP的可比性研究选择的潜在质量属性。此外,可以根据特定修改的风险状况、从以前的工艺表征中获得的工艺知识、以及特定特征 (如偶联技术) 来证明质量属性的选择是合理的。- 对于mAb中间体,建议在工艺变更后比较纯度、结合特异性、一级和高级结构。针对效力的可比性研究类型将取决于ADC的作用方式。如果没有证据表明ADCC或CDC活性与ADC的功效相关,则研究这些就没有价值,可以省略。
- 对于药物连接子中间体,其可比性研究侧重于纯度和杂质概况以及种类的比较。对于在mAb中间体或药物连接子中间体中发现的杂质或修饰,建议考虑它们对后续偶联过程的影响 (区分可偶联和不可偶联的杂质) 以及对DS和DP质量属性影响的可能性。
对于DS和DP,为DS可比性研究选择的质量属性包括药物与抗体的比率 (DAR)、纯度、效力以及一级和高级结构。如果工艺特性和产品知识已经可用,则可以使用这些信息来证明可比性研究的设计。例如,如果证明DS的DAR在工艺变更前后具有可比性,并且DAR分布在稳定期间不会发生变化,则有理由不在DP级别测试稳定性。
表 2. 为mAb中间体,药物连接子中间体,DS和DP的可比性研究选择的推荐质量属性
关于稳定性方面,适用于其他生物制剂的基本原则同样适用:- 在GLP毒理学和GMP临床材料之间进行的可比性研究中,通常不需要并行比较稳定性数据。
- 如果在临床研究期间或商业批准后发生工艺变化,可比性研究应包括并行比较稳定性数据,即稳定性方案需要预见稳定性结果的比较。
对于mAb中间体、DS和DP可比性,有限时间的强制降解研究和并行比较可能比实时和应力研究方案更具参考价值。如果化学或生化特性的差异明显,分析可比性研究不足以在工艺变更和/或加速的开发后建立可比性,则采用来自非临床或临床研究的额外证据是合适的 (类似于其他生物制剂)。非临床和临床研究的范围和性质将根据各个申办方的判断逐案确定。这些研究的目的是能够比较工艺变更前后的材料。例如,如果有足够的证据,影响保留时间或结合亲和力的变化可以证明在啮齿动物中进行PK研究是合理的 (而不是在人类中进行)。在适当的情况下,这些研究应该是直接的比较研究。
在早期开发阶段进行的可比性研究不需要可比性方案,例如GLP毒理学批次和GMP临床批次之间的比较。在早期开发中,由于对特定项目的知识和经验有限,无法为可比性方案设定适当的可接受标准。但是,对于在临床开发后期或商业批准后进行的可比性研究,足够的生产经验和临床数据可以支持设定标准,强烈建议采用正式的分析可比性方案。- 早期阶段 (GLP毒理与GMP临床批次):在早期开发期间进行的可比性研究通常侧重于评估与安全性相关的质量属性,例如杂质概况、药物载量 (DAR) 和效力。一个来自GLP毒理学工艺的批次和一个来自GMP临床工艺的批次足以评估药物开发这一阶段的可比性。通常,GMP临床材料应具有与GLP毒理学材料相当或改进的质量属性 (例如纯度提高)。毒理学批次和临床批次之间应保持可比的DAR值。ADC的效力应包括在评估中,并应证明毒理学和临床产品之间的细胞毒性相当。除非GMP生产工艺与GLP毒理学有显著差异,否则通常不需要比较稳定性数据 (加速和/或压力稳定性) 来证明可比性。
后期阶段 (临床工艺与关键工艺):后期开发期间进行的可比性研究应包括与安全性、功效、质量和稳定性相关的质量属性评估。应比较纯度/杂质概况、药物载量 (DAR)、效力、初级和高级结构。建议包括现有和新工艺的合适批次,并应涵盖工艺变化。应证明DAR和效力可比。与初始工艺相比,杂质分布可比或改善是可以接受的。应生成稳定性数据 (加速和/或应力稳定性) 以支持可比性的确定。
通用技术文件 (CTD) 的结构
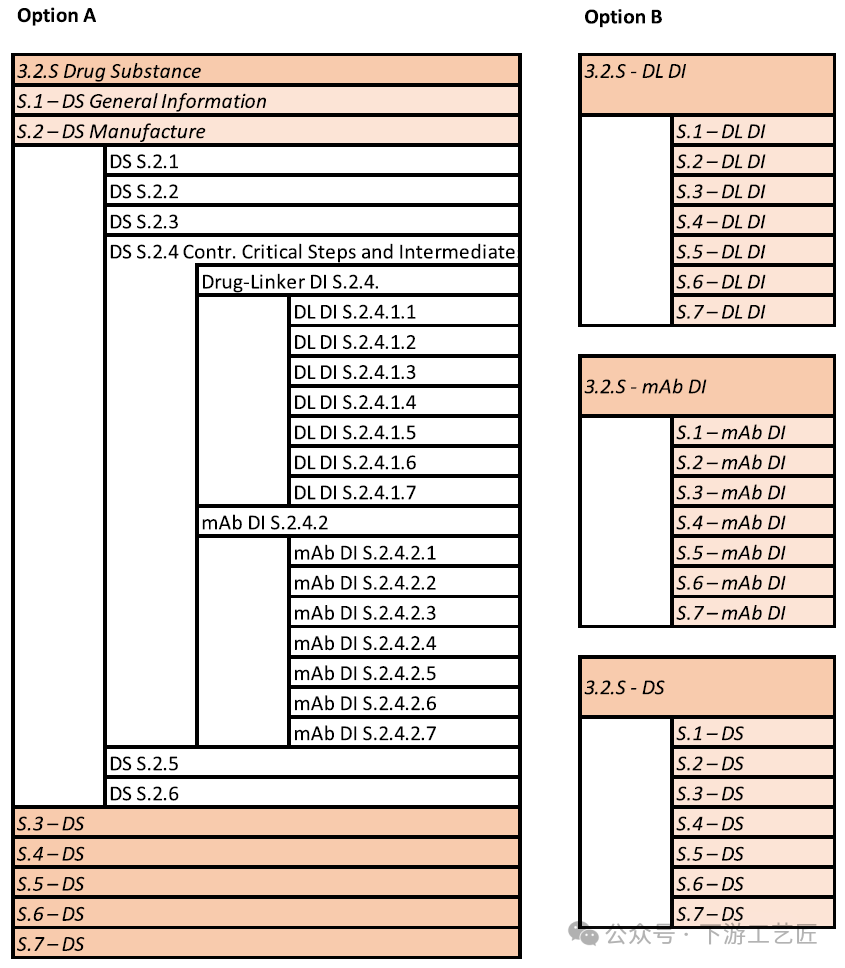
ICH通用技术文件质量部分M4Q提供了有关在注册申请中DS和DP的注册档案中呈现CMC信息的统一结构和格式的指导。档案结构不应受到限制,只要化学、制造和控制信息在档案中的位置合适且易于找到即可。然而实际上,为了确定格式是否适用于特定类型的产品 (例如ADC),根据作者的经验,建议申请人在提交档案之前咨询相应的监管机构,以便满足审阅者/评估员的期望。申请人可以根据遇到的具体情况灵活地选择最合适的格式。下面简要介绍了两种最常见的ADC注册申请档案格式 (图10),它们并不严格遵循eCTD格式 (但据报道已被接受)。根据产品和情况,也可以考虑两种档案格式之间的混合。- 选项A:一个DS文件夹档案:药物、连接子、药物连接子和裸mAb是ADC药物物质中间体,其CMC信息嵌套在DS模块3.2.S.2.4, 3.2.S.4和其他相关部分中。S.2.4部分可根据需要为每个DS中间体划分子部分。
- 选项B:有单独的多个3.2.S文件夹 (例如ADC DS,药物连接子中间体,mAb中间体各一个,如果适用,可能还有药物中间体和连接子中间体)。每个文件夹都有一组文档即3.2.S.1至3.2.S.7。根据ICH M4Q指南,当一种药品中使用多种药物成分时,信息应单独呈现为一个完整的药物成分,随后是同一许可证下的其他完整药物成分部分。
- 优缺点和推荐:一个DS文件夹 (选项A) 和多个DS文件夹 (选项B) 档案都有各自的优势。作者建议采用选项B的方法,因为它有助于行业准备档案和卫生当局审查。它还可以高效管理后续生命周期活动,组织简单,并提供有关ADC DS,药物连接子中间体和mAb中间体的CMC信息。
作者想强调的是,无论采用哪种选项都不会将中间体 (旨在实现偶联和准备适当最终产品的规范)和DS (旨在描述安全有效的活性成分的规范) 的期望和要求视为可比的。正如本文前面所述,减少不必要或多余的工作以促进ADC的开发应该是最重要的目标。如果多个ADC产品使用相同的药物连接子或mAb,则可以重复使用每个单独的药物连接子或mAb文件夹,或在产品之间进行交叉引用。跨多个ADC产品使用ADC组件提供了一个利用平台先前知识的明确机会,这些知识应在档案中适当呈现,或者可以使用药物主文件 (DMF) 来支持使用单个档案的多个产品 (适用于所有选项)。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容