一、关于将酒石酸艾格司他胶囊纳入《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》试点项目的公示
https://www.cde.org.cn/main/news/viewInfoCommon/1dd3dc2fe02a1e5f77dff31d950ae318依据《以患者为中心的罕见疾病药物研发试点工作(“关爱计划”)申报指南》,现将拟纳入“关爱计划”试点项目的基本信息予以公示,公示时间截止至2025年2月28日。工作要点:面向戈谢病患者人群,设计调研问卷,收集国内患者体验数据以及治疗偏好,使用定性、定量方法进行分析。如有异议,请将具体意见发送至邮箱:zhaona@cde.org.cn。
一、国家药监局关于复方公英胶囊转换为非处方药的公告(2025年第17号)
https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20250219112912133.html根据《处方药与非处方药分类管理办法(试行)》(原国家药品监督管理局令第10号)规定,经国家药品监督管理局组织论证和审核,复方公英胶囊由处方药转换为非处方药。品种名单(见附件1)及非处方药说明书范本(见附件2)一并发布。请相关药品上市许可持有人于2025年9月30日前,依据《药品注册管理办法》(国家市场监督管理总局令第27号)等有关规定,就修订说明书事项向省级药品监督管理部门备案,并将说明书修订的内容及时通知相关医疗机构、药品经营企业等单位。非处方药说明书范本规定内容之外的说明书其他内容按原批准证明文件执行。药品标签涉及相关内容的,应当一并修订。自补充申请备案之日起生产的药品,不得继续使用原药品说明书。双跨品种的处方药说明书可继续使用。二、国家药监局关于修订氟尿嘧啶注射剂说明书的公告(2025年第18号)https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypshmshxdgg/20250221114058101.html
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对氟尿嘧啶注射剂说明书内容进行统一修订。现将有关事项公告如下:
一、所有上述药品的上市许可持有人均应当依据《药品注册管理办法》等有关规定,按照附件要求修订说明书,于2025年5月8日前报国家药监局药品审评中心或省级药品监督管理部门备案。修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换或以其他形式将说明书更新信息告知患者。二、药品上市许可持有人应当对新增不良反应发生机制开展深入研究,采取有效措施做好药品使用和安全性问题的宣传培训,指导医师、药师合理用药。三、临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。四、患者用药前应当仔细阅读药品说明书,使用处方药的,应当严格遵医嘱用药。五、省级药品监督管理部门应当督促行政区域内上述药品的上市许可持有人按要求做好相应说明书修订和标签、说明书更换及说明书更新信息的告知工作,对违法违规行为依法严厉查处。
一、浙江省药品监督管理局
(一)浙江省药品监督管理局2024年法治政府建设年度报告https://mpa.zj.gov.cn/art/2025/2/20/art_1228989285_58939526.html2024年,省药监局坚持以习近平新时代中国特色社会主义思想为指导,深入学习贯彻习近平法治思想,全面贯彻落实党的二十大和二十届二中、三中全会精神,认真落实省委十五届五次、六次全会精神,聚焦监管主责主业,统筹发展和安全,统筹效率和公平,统筹监管和服务,全力筑牢药品安全底线,全力助推医药产业高质量发展。一、2024年推进法治政府建设的主要举措和成效
(一)持续推进法治建设。加强习近平法治思想学习,落实集体学法制度,将习近平法治思想列入省局党组理论学习中心组专题学习内容,编制年度法治宣传教育个性工作责任清单。加强业务培训,组织干部学法用法考试和法制、稽查专题培训,增强尊法学法用法守法意识。强化执法监督,编制年度行政执法工作计划,根据法律规章立改废释情况动态调整执法事项清单,开展委托下放许可事项实施情况专项监督,组织行政处罚案卷评查和优秀案件交流,切实规范监管执法。全年办理行政复议案件12件、行政诉讼案件3件,连续七年复议案件零撤销、诉讼案件零败诉。(二)持续健全法规制度。根据国家药监领域法律法规调整情况,完善我省药品和医疗器械管理地方立法草案内容。主动参与国家药监局立法工作,研究反馈《药品管理法实施条例》修订、医疗器械管理立法、药品医疗器械质量安全“吹哨人”举报实施奖励办法等征求意见。全面梳理《浙江省医疗机构药品和医疗器械使用监督管理办法》所涉罚款事项,联合省市场监管局印发《浙江省市场监管领域依法不予实施行政强制措施事项清单》,修订《行政处罚案件负责人集体讨论制度》。公布年度重大行政决策事项目录,全面落实规范性文件合法性审核机制和公平竞争审查制度,严把审查关,全年出台行政规范性文件5件。(三)持续优化营商环境。推动制定药监领域增值化改革实施方案,制定支持药品、医疗器械、化妆品3个领域发展举措,配套出台“四重”服务、“柔性”服务2个管理办法和若干改革试点方案,形成“1+3+2+N”药监政务服务增值化制度体系,相关改革工作多次被国家药监局推广。成功争取国家“优化药品补充申请审评审批程序改革”试点,成立全国首个由药监系统内单位承担的医疗器械产业专利导航基地,全国率先开展药品生产企业“搬迁一件事”、药品流通“多仓一体化”、医疗器械“研审联动”改革试点,提升审评审批质增。2024年,我省获批的创新药、国内首仿药、创新医疗器械和进入国家、省创新审批通道总数位居全国前列,化妆品新原料通过备案量创历史新高。(四)持续完善监管体系。全国率先成立浙江省药品安全风险管理控制中心,构建信息传递、评估会商、处置转办和风险关闭等风险评估闭环机制。深化“1+4+1+X”省市县协同监管体系,制定加强跨区域跨层级药品监管协同指导意见,提升省市县三级监管协同效能。深化“1+11+N”三级药品检查体系,探索县级药品检查员队伍建设新模式,推动设立全省首家县级药品检查中心。深化药品监管专业能力建设,实施“执法雄鹰”“尖兵领航”等工程,举办全省首届药品检查技能竞赛、中药材鉴别职业技能竞赛,积极营造“比技术、学技能”的良好氛围。积极推动长三角跨区域监管协作,签订长三角药品跨省委托生产协同监管合作、药械化跨省委托生产协同监管信息化项目等协议。(五)持续筑牢安全底线。加强重点品种重点企业重点领域监管,全年开展省级飞行检查305家次,药械化抽检16072批次,监测收集药械化不良反应报告15.3万余份。全省12315平台受理药品投诉举报10450件,按期受理率、办结率均达100%。深化药品安全巩固提升暨打假治劣“药剑”行动,聚焦疫苗监管、网销监管、医美整治、中药材、染发类化妆品等重点领域,严查重处违法违规行为。全省全年办结药械化违法案件4894件,罚没款1.22亿元,移送公安机关涉嫌犯罪案件51件,6起案件入选国家药监局典型案例库,1件入选国家药监局首批涉嫌犯罪案件移送证据标准案例。承办国家级医疗器械安全突发事件应急演练,组织省级化妆品安全突发事件应急演练,提升突发事件应急处置能力。(六)持续深化法治宣传。组织新修订《中华人民共和国行政复议法》和《药品监督管理行政处罚裁量适用规则》专题培训,开展《浙江省优化营商环境条例》宣贯,更新领导干部应知应会党内法规和国家法律法规清单。开设专栏持续推送新近出台药品监管领域相关政策、法律法规文件解读。开展“《中华人民共和国药品管理法》颁布40周年”专题宣传,举办“医疗器械‘浙’十年”“‘生态美妆’全国媒体看浙江”等系列主题活动,多方位展现浙江药械化监管领域创新实践和亮点成果。二、2025年推进法治政府建设的主要安排
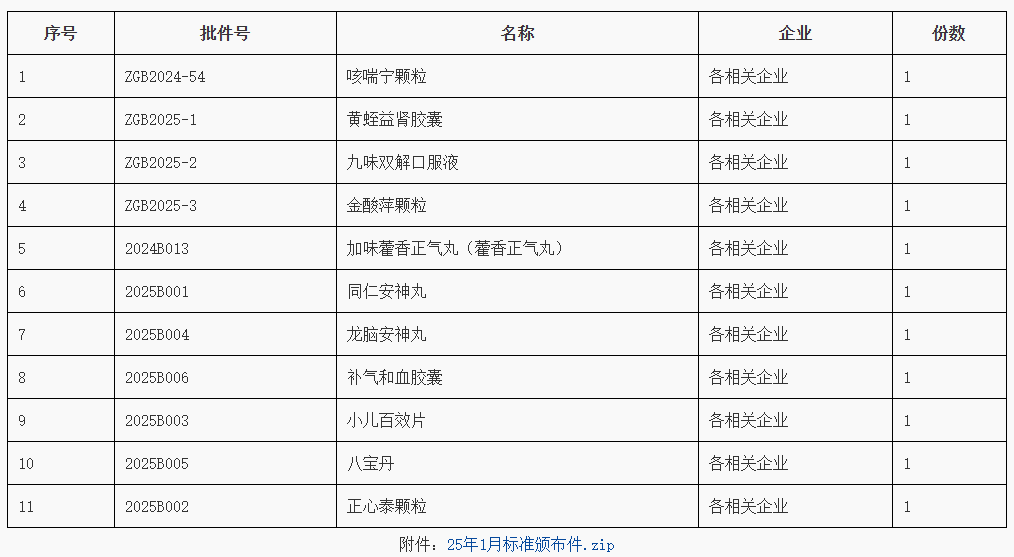
2025年,省药监局将坚持以习近平新时代中国特色社会主义思想为指导,深入学习贯彻习近平法治思想和习近平总书记关于药品监管重要指示批示精神,认真落实省委、省政府和国家药监局各项决策部署,以高标准的法治建设和改革举措,全面完成药品安全“十四五”目标任务,加快推进省域药品监管现代化先行,为高质量发展建设共同富裕示范区贡献药监力量。(一)增强法治思维能力。把学习贯彻习近平法治思想,同党的二十届三中全会和省委十五届五次、六次全会精神学习紧密结合起来,用好党组理论学习中心组学习、干部教育培训等载体,采用集体学习、专题辅导、集中培训等多种形式开展学习、指导实践,持续提升领导干部运用法治思维水平,提高以法治方式推动发展、化解矛盾、维护稳定、应对风险的能力。(二)完善政策制度体系。坚持“以良法促进发展、保障善治”,持续推进药品医疗器械地方立法调研论证,加强重点领域政策文件立改废力度。制定年度重大行政决策目录,完善法律顾问和公职律师参与机制,加强决策风险评估,提高决策质量和效率。强化规范性文件管理,全面落实合法性审核机制和公平竞争审查制度。(三)改革赋能优化服务。围绕贯彻落实习近平总书记关于药品监管重要指示批示精神、党中央国务院和省委省政府决策部署、企业基层群众“急难愁盼”等,系统谋划部署推进重大改革项目。积极争取承接国家药监局改革创新试点,探索建立药品技术审评、抽样核查分级分类管理模式,推进注册核查和GMP符合性检查协同开展,推动审评检查省市联动试点改革等,加快培育发展新质生产力,推动我省医药产业高质量发展。(四)提升行政执法水平。严格规范性文件管理、公平竞争审查、重大案件法制审核,动态管理执法人员资格及行政执法事项清单,规范执法水平。严格行政执法程序,全面落实行政执法“三项制度”,加强处罚文书释法说理,持续组织开展案卷评查,提高执法能力。建立行政复议应诉工作制度,构建纠错案件闭环处置机制,推动行政争议实质化解,降低执法风险。(五)强化法治宣教实效。落实“谁执法谁普法”普法责任制,制定个性普法计划,明确任务清单,完善工作体系。加强执法人员依法行政能力培养,全面实施企业落实质量安全主体责任监管规定,有序引导消费者依法维权,营造三方共赢的药品监管法治环境。创新普法方式,推进“以案释法”,发布药监领域典型案例,开展社会热点案件解读。高标准做好“八五”普法收关,高质量谋划“九五”普法规划。https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/bjah-index-dept!detail.action?originalId=AH25021900281Q:已上市化学药品在包装及说明书上增加商标,变更说明书不涉及技术审评的企业联系方式信息需不需要省局备案?A:网民您好!关于您咨询的问题,经核实回复如下:根据《已上市化学药品和生物制品临床变更技术指导原则》,更新持有人的联系信息属于微小变更。《药品注册管理办法》第七十九条规定,药品包装标签内容的变更,持有人应当在变更实施前,报所在地省级药品监督管理部门备案。北京市药品监督管理局 2025年2月20日(一)国家药品标准颁布件(含修订件、补充颁布件、修订颁布件)(202501)http://mpa.gd.gov.cn/zwgk/jgsz/zcc/zlbzj/content/post_4669894.html
(一)中检院公开征求《中药材及中药饮片国家药品标准研究用代表性样品提交并留存中检院程序规范(征求意见稿)》意见
https://www.nifdc.org.cn/nifdc/xxgk/ggtzh/tongzhi/202502210846521451748.html为贯彻落实《中药标准管理专门规定》,中检院起草了《中药材及中药饮片国家药品标准研究用代表性样品提交并留存中检院程序规范(征求意见稿)》,现向社会公开征求意见,请各有关单位于3月10日前将意见反馈至zysbbg@nifdc.org.cn,请在电子邮件主题注明“文件名称—意见建议反馈”。 附件:《中药材及中药饮片国家药品标准研究用代表性样品提交并留存中检院程序规范(征求意见稿)》
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容