
2025-04-01 00:00:00来源:微谱生物科技浏览量:581
单克隆来源评价是生物制药,尤其是单克隆抗体药物开发中至关重要的质量控制环节,其核心意义在于确保治疗产品的一致性、安全性和有效性。缺乏严格的单克隆验证可能导致药物失效、临床试验失败或上市后召回等严重后果。本期专家解读,将开启单克隆来源评价系列的第1期。

1997 年 ICH Q5D 的第 2.1.3 章节指出:
“对于重组蛋白产品,细胞底物是含有所需序列的,来自于单个细胞前体的转染细胞。”
1997年FDA在《用于人类使用的单克隆抗体产品的制造和测试需考虑的事项》中指出:
“主细胞库被定义为来自单一组织或细胞的具有均匀组成的细胞集合。”
2013 年 WHO 生物标准专家委员会 47 在第 111 页陈述了如下内容:
“在单克隆细胞培养过程中,应选择单个细胞进行扩增。应当详细记录克隆过程,包括原始培养物的来源、克隆的方案以及所用的试剂。通过一轮有限稀释获得的克隆不一定能够保证来自于单一细胞,应当执行其他的亚克隆步骤… ... 克隆过程需要充分的文件记录,并附有详细的成像技术和/或适当的统计数据。对于使用重组质粒 DNA 技术转染的蛋白质,如果能够在整个的生产过程以及超出生产过程之外的细胞代次内证明产品同质性和一致的产品特征,那么一轮完整记录的克隆即已经足够。”

2.1 行业挑战
2016年,礼来公司等联合发表了一篇名为《生物制药生产细胞系“克隆性”相对重要性的行业观点》的综述,阐明对于制药行业的产品质量来说,应该着重监管生产工艺与产品质量检测;提出“单克隆性”是错误概念,理由是CHO细胞自身有基因重排等不稳定性,传代培养后会积累遗传与表型异质性;同时,历来的生物制品生产体系也存在非单克隆性的群体细胞,不影响产品的质量。

▲ 图源 | Frye C, et al., Industry view on the relative importance of “clonality” of biopharmaceutical-producing cell lines, Biologicals (2016).
2.2 监管回应
2019年,CDER办公室主任Joel T. Welch也在相同期刊上发表一篇名为《考虑“克隆性”:对生物制药开发中哺乳动物细胞库克隆衍生重要性的监管观点》的综述,阐明虽然CHO细胞系是不可稳定的会形成一个遗传和表型多样化的家族,体现在单核苷酸多态性(SNPs)、拷贝数变异和染色体型中。

▲ 图源 | Joel T. Welch.,Considering “clonality”: A regulatory perspective on the importance of the clonal derivation of mammalian cell banks in biopharmaceutical development, Biologicals (2019)
通过对比非单克隆来源与单克隆来源的细胞,在生产稳定性上来说,尽管非克隆衍生库在收获时可能与克隆衍生库具有相同的CQA平均值,但其克隆期间的不同起点可能会导致一个或多个CQA的更大变异性,以及在制造期间可能更容易受到漂移、移动和不可预见的选择压力的影响。如下图所示。
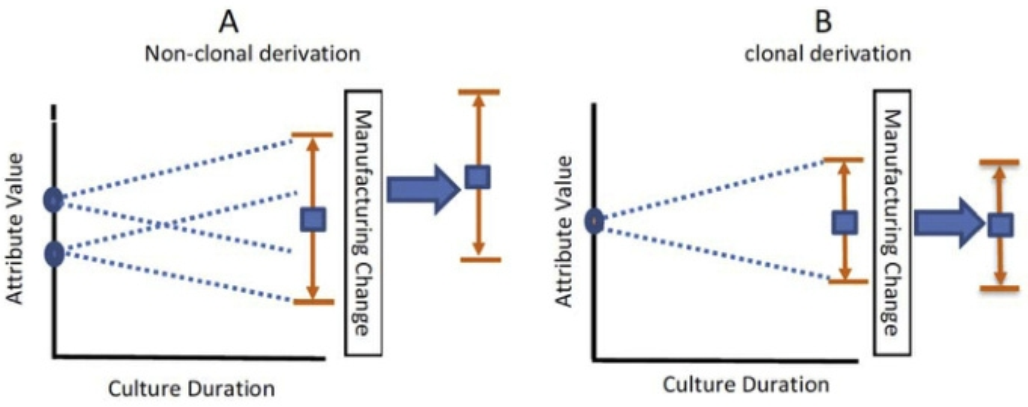
▲ 图源 | Joel T. Welch.,Considering “clonality”: A regulatory perspective on the importance of the clonal derivation of mammalian cell banks in biopharmaceutical development, Biologicals (2019)

目前,无论是CDE还是FDA对于重组蛋白抗体的上市阶段,均要求补充细胞库单克隆来源的验证资料,以此评估生产工艺与质量控制的策略是否能够保证产品的稳定性。
但在IND及研发阶段,有的通过有限稀释法以及单克隆拍照的方式证明单克隆来源;有的通过ClonePix或FACS以及其他分选仪器进行分选,再进行一轮有限稀释和单克隆拍照来证明单克隆来源;有的未在建库之前完成单克隆的无血清驯化改造。如果前期对于MCB是否单克隆衍生评价的不充分,需要在BLA阶段补充单克隆来源的验证试验从染色体水平(FISH)与基因水平(NGS或Southern Blot)来提供证明。
目前监管越来越关注在研发阶段或IND阶段,提供筛选的方法与数据对于单克隆株的评价更为重要;同时也影响后续生产工艺与质量控制的策略。如果前期缺乏对于单克隆细胞株的筛选与评价数据,那么需要增加更加严格的工艺控制与质量控制策略。

从法规与审批要求来看,对于单克隆来源的验证要求,根据单克隆分选的方式、是否有照片跟踪资料、研发阶段的筛选评价、有无整合位点的分析等,决定IND阶段与BLA阶段分别对于MCB/WCB与EOPC进行验证检测。主要的检测方法包括:
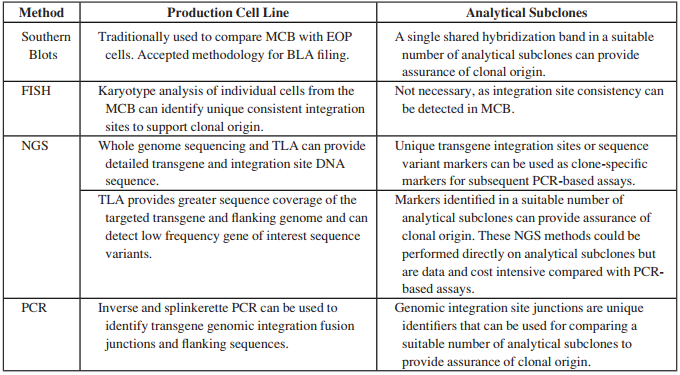
▲ 图源 | Paul Wu., et al., Advancing Biologics Development Programs with Legacy Cell Lines: Advantages and Limitations of Genetic Testing for Addressing Clonality Concerns Prior to Availability of Late Stage Process and Product Consistency Data, PDA Journal of Pharmaceutical Science and Technology

微谱生物科技可以为客户提供FISH检测简化版与标准版、Southern Blot、NGS整合位点分析、单细胞分选等检测服务,能够满足研发阶段、IND申报阶段与BLA申报阶段的单克隆来源验证服务。
参考单克隆来源验证解决方案如下表所示:
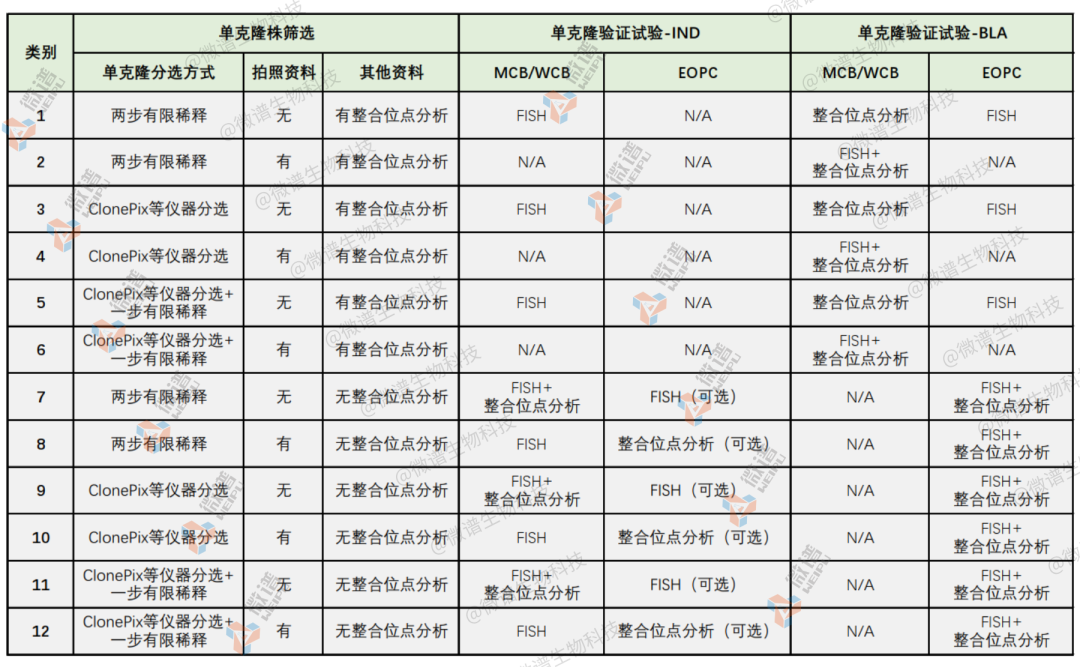
▲ 图源 | 微谱生物科技