
2025-06-18 15:35:02来源:CDE浏览量:2228
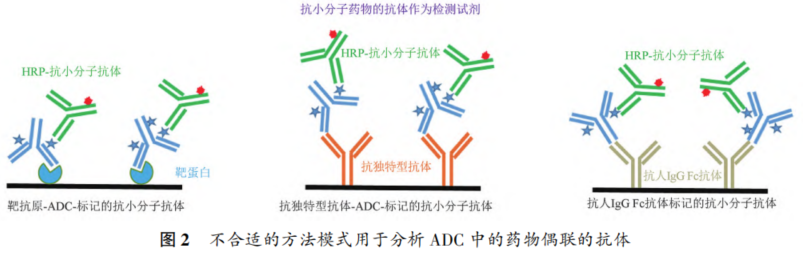
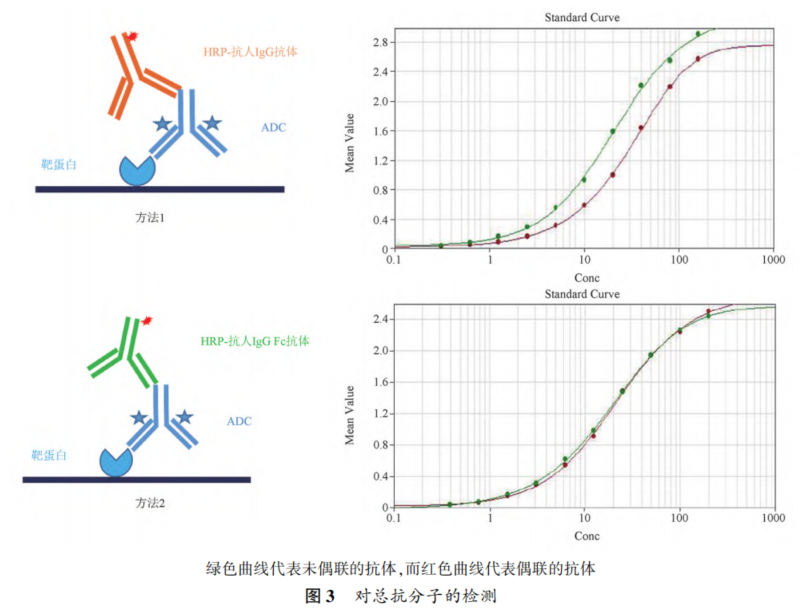
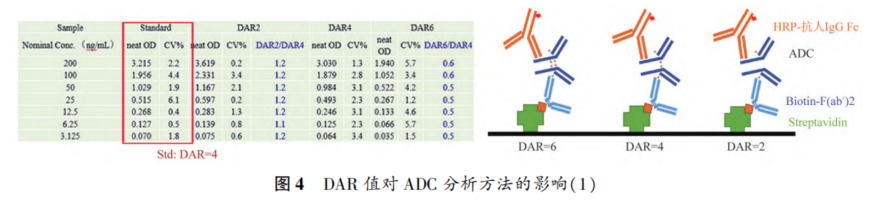
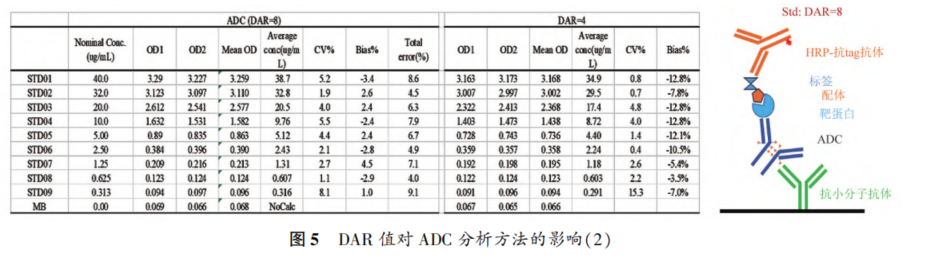
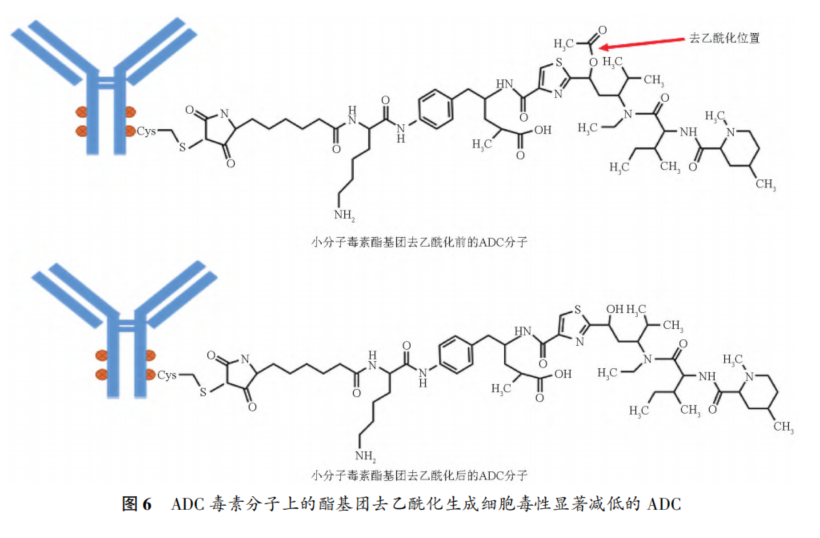
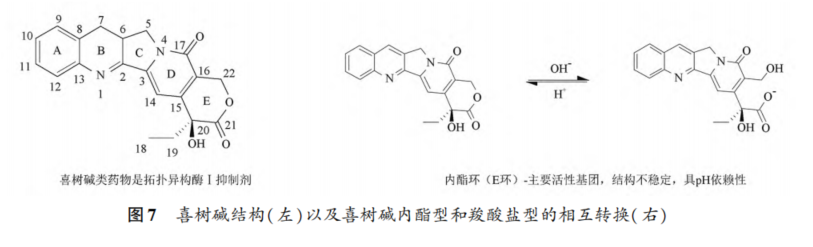
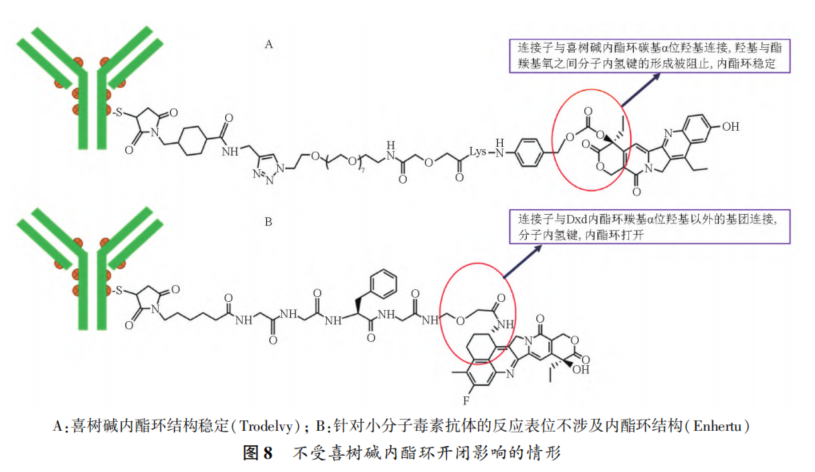
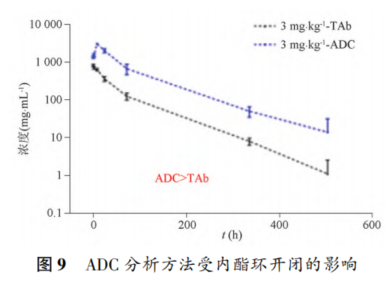
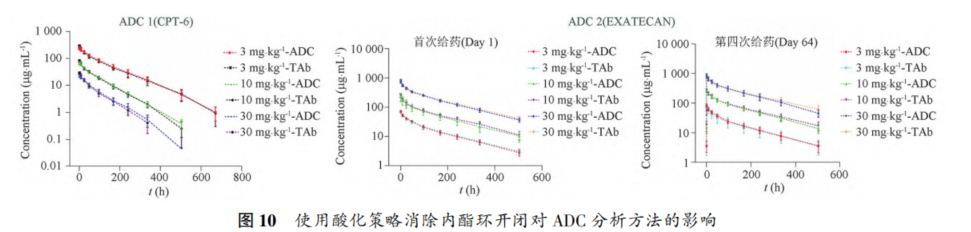
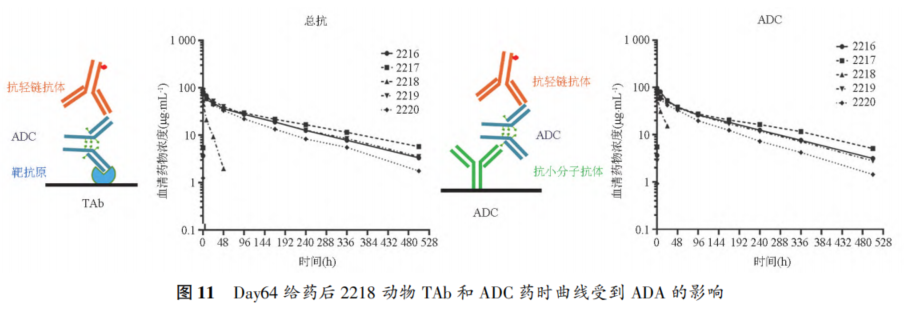
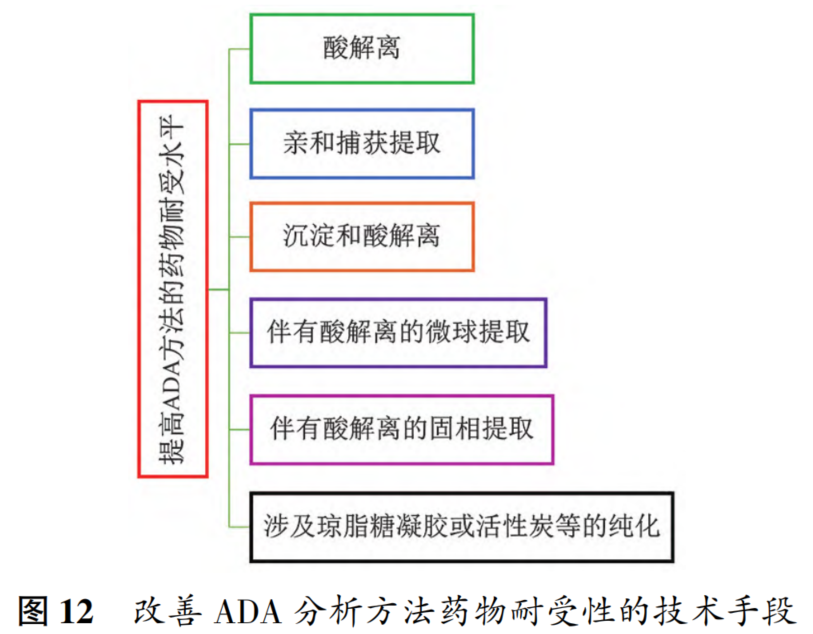
摘要 抗体药物偶联物(ADC)是一类新的生物治疗药物,通常由细胞毒性有效载荷通过连接子与抗体共价结合组成。ADC在体内经历不断的脱偶联和生物转化过程,导致形成复杂且结构不均一的混合物,除了脱偶联的游离抗体和游离载荷外,还存在不同程度与小分子药物偶联的ADC分子,因此,对生物分析方法的开发带来很大挑战。为了解ADC药物在非临床和临床研发阶段的药代和药效特征,以及免疫原性和安全性,对给药后体内存在的不同分子形式的实体比如药物偶联的抗体、裸抗和总抗体等需要使用不同的方法进行分析。本文总结了在ADC药物分析方法开发中遇到的较为常见的技术问题并提供相关的解决方案,以期为相关的分析方法开发提供参考,促进ADC药物安全有效地开发。 关键词 抗体偶联药物;配体结合分析;药代;抗药抗体;生物分析 正文 大分子生物药近年来迅猛发展,特别是抗体药物偶联物(Antibody drug conjugate,ADC)是药物市场增长最快的生物药之一,ADC药物在肿瘤的靶向治疗中发挥着重要的作用。ADC药物结构不同(抗体结构、靶点、药物载荷、连接子和药物抗体比),在体内的表现和给药策略也不一样。了解这些药物在非临床和临床研发阶段的药代和药效特征,以及免疫原性和安全性,可以对ADC在体内的作用机制和生物过程进行准确和全面的评估,从而促进安全有效的ADC药物的开发。 生物分析为非临床和临床研究提供各种关键数据,用于计算和评估各种药代/毒代等参数指标,是药物开发中的重要环节。药物的生物分析方法应稳健和可靠,满足特定研究相关的样品检测需要,能为非临床和临床研究提供准确的数据。 ADC药物因体内代谢复杂,构建合适的ADC生物分析方法需要考虑众多不同的因素。如对于定量的分析方法,首先要遵循等分子检测的原则,即在相同的分析条件下,一分子的标准品产生的检测信号与一分子的待测物产生的检测信号应该相同。其次需要明确待分析的分子是游离形式还是总分子,是完整分子还是部分分子。此外,要了解各个关键试剂对不同状态下的ADC药物分子的结合反应性,基质中是否有游离靶标和结合蛋白的存在;并需要了解类似物与代谢物的情况,以及方法对抗药抗体的耐受程度等[1,2]。 在本中心的生物分析实践中,ADC不失为一类对生物分析方法的开发具有很大挑战性的药物。由于经历分解代谢和生物转化过程,导致ADC药物在体内具有异质性,存在着多种形式ADC分子以及多个ADC药物的组成分子。因此,对ADC药物的分析需要包含ADC以及不同的组分,涉及到多种分析方法。本文例举在ADC药物配体结合生物分析方法开发工作中遇到的较为常见的技术问题并提供相关的解决方案,以期为生物分析人员提供参考,保障ADC药物评价相关生物分析数据的准确性。 使用合适的分析方法模式 使用不合适的分析方法模式的错误一般会出现在PK(Pharmacokinetics)方法中,特别是对药物偶联抗体的检测。除了脱偶联的游离抗体和游离载荷外,ADC在血基质中的异质性主要表现为存在不同程度与小分子药物偶联的ADC分子。对于不同分子形式的分析物实体,比如药物偶联的抗体、抗体偶联的药物、总抗体、未偶联的抗体(裸抗)和游离药物分子,需要使用独立的方法进行分析。通过比较药物偶联抗体与总抗体的水平可以了解ADC脱偶联的程度,而通过比较抗体结合的药物分子与总抗体的水平可以得到ADC的平均DAR(Drug antibody ratio)值[3]。 用于分析药物偶联抗体合适的分析方法应以抗小分子药物的抗体作为包被试剂,再以标记的药靶分子或者抗ADC药物的独特型抗体或抗人IgG Fc抗体作为检测试剂,见图1。该检测方法模式体现了等分子检测的原则,保证了对药物偶联抗体的准确检测。 用于分析药物偶联抗体的不合适的分析方模式以靶标或者抗ADC药物的独特型抗体或者抗人IgG Fc抗体作为包被试剂,再以标记的抗小分子药物作为检测试剂,见图2。这种方法产生的结合信号除了反映ADC分子的数量外,还受到ADC分子中小分子数目的影响,该分析模式违反了等分子检测的原则,最终将导致药物偶联的抗体的检测不准确。 ADC总抗体分析方法 受 DAR值的影响 ADC总抗体的检测中包含对药物偶联的抗体和药物未偶联的抗体(裸抗)两种组分的分析,其中药物偶联的抗体存在异质性。在构建总抗体的分析方法时,应避免使用对偶联抗体和裸抗存在差异结合的关键试剂,否则总抗体分析方法的准确性会受到影响[4]。 在图3的方法1中以靶抗原作为包被试剂,以标记的抗人IgG为检测试剂,结果显示未偶联抗体的结合信号明显高于药物偶联的抗体的结合信号,说明方法1中的关键试剂对药物偶联的抗体和裸抗的结合反应存在差异;然而,当方法1中的标记抗体更换为标记的抗人IgG Fc的抗体时,未偶联抗体的结合信号与药物偶联的抗体的结合信号基本一致(方法2),说明方法2中的关键试剂对药物偶联抗体和裸抗的结合反应不存在差异,是检测总抗体的正确方法。综合2种方法的检测结果,可见造成方法1中的未偶联抗体和偶联抗体的结合信号差异的原因来自标记的抗人IgG试剂。 ADC分析方法受DAR值的影响 对于ADC分子而言,给药后体内DAR值因脱偶联而随时间变化,总体来说,DAR值在ADC给药后趋向变小。因此,导致定量分析的ADC参考标准品与体内研究样品中的ADC的DAR值互不相同,这种差异在给药后期(比如PK试验)的时间点采集的样品中表现得尤为明显。如果在ADC检测中使用的关键试剂受到DAR值不同的影响,那么ADC的浓度将不能代表分析物的真实浓度,从而影响研究数据的解读[3]。 图4中所示的ADC分析方法是以抗小分子药物的F(ab’)2作为捕获试剂,抗人IgG Fc的抗体作为检测试剂来构建的。结果发现方法在DAR值为4以下时影响较小,但当DAR值增加到6时,信号值明显下降。因此,采用DAR值为4的ADC作为标准品开发的分析方法基本不受DAR值的影响。 另一个例子中的ADC分析方法以抗小分子药物作为捕获试剂,靶蛋白和靶蛋白表面的标签以及标记的抗标签抗体为检测试剂,见图5。这里的标记试剂利用了靶蛋白分子上的标签分子,而不是直接使用生物素或HRP标记的靶蛋白作为检测试剂,原因是生物素或HRP标记的靶蛋白显著地失去了与ADC结合的能力。相关的实验结果显示,以DAR值为8的ADC作为分析的参考标准品时,DAR值为4的ADC的检测未见受到影响。该项目中未能获得DAR值为2的ADC测试物用于更低DAR值影响的评估,但由于DAR值为8和4时时ADC与靶蛋白的结合相当,鉴于该ADC分子为定点偶联产品,故认为在低DAR值情形下ADC与靶蛋白的结合很大概率不会受到影响。 ADC的分析方法 受小分子状态的影响 ADC生物分析的挑战性还可源于与抗体偶联的小分子的状态。ADC在体内经历的生物转化和分解代谢过程可能使ADC分子上的小分子毒素的结构发生改变,生成小分子毒素代谢转化后的细胞毒性增加或降低的ADC分子。相应地,在循环中会有2种游离小分子毒素的存在,即未代谢转化的毒素分子和代谢转化后的毒素分子(即毒素代谢产物)。由于总抗体和总ADC浓度反映药物在体内的有效性和靶毒性,因此,在这种状态下的大分子生物分析指标应该检测总抗体,小分子毒素未被代谢转化的ADC分子(即ADC产品本身)和小分子毒素被代谢转化过的ADC分子。由于游离小分子毒素的水平与体内的非靶毒性相关,那么对游离小分子毒素的生物分析也应包含修饰过的小分子毒素和未修饰过的小分子毒素。Faria等报道[5]ADC的小分子毒素分子上有一个酯基团易被裂解导致去乙酰化而形成修饰过的小分子毒素,见图6。 研究发现乙酰基团的缺失会导致小分子毒素的效力显著减低,并且小分子毒素的去乙酰化可以在与抗体结合时发生,从而生成小分子毒素去乙酰化代谢转化后的ADC。另外,小分子毒素的去乙酰化也可以在其从抗体中释放后发生,是毒素分子代谢产物的一种来源。在这类产品的临床样品中对ADC分子进行PK评估时,需要开发并验证几种不同的生物分析方法来分析总抗体,ADC产品本身,小分子毒素代谢转化后的ADC,游离小分子毒素和小分子毒素代谢产物。 近年来,ADC趋向于采用更高的DAR值和效力较低的细胞毒素来设计[6]。例如,使用SN⁃38作为有效载荷的靶向TROP2的Sacituzumab Govitecan(IM⁃MU⁃132)和以DXd为有效载荷的靶向HER2的Tras⁃tuzumab Deruxtecan(T⁃DXd)已分别成为治疗三阴性乳腺癌和HER2高表达或低表达乳腺癌的有效ADC,说明了喜树碱类衍生物(SN⁃38或Dxd)作为有效载荷的优势,使得喜树碱衍生物成为ADC领域的研究热点之一[7,8]。 关于喜树碱类ADC药物的分析方法,除了需要考虑上面提到的相关因素外,还需考虑分子中内酯环开闭对方法的影响。SN38是DNA拓扑异构酶I的抑制剂,分子中有A,B,C,D,E五个环状结构,见图7,其中E环为内酯环,是主要的活性基团,但结构不稳定,内酯环具pH依赖性,在pH上升时会打开,内酯环打开时喜树碱失去生物活性[9]。 内酯环的开闭会给ADC的分析方法带来影响,但在下面2种情况下,见图8,这种影响可以不考虑[10]。 (1)如果连接子与SN38内酯环羰基α位羟基连接,那么羟基与羰基氧之间的分子内氢键的形成会被阻止,内酯环稳定地处于闭环状态,这样便导致体内仅有-种分子形式存在。 (2)如果连接子与羰基α位以外的基团连接,那么分子内氢键形成,内酯环打开,但如果针对SN38的抗体的反应表位不含内酯环结构,那么内酯环开闭便对这类抗体没有作用。 除以上这2种情况外,需要考虑内酯环开闭对ADC分析方法的影响,原因是: (1)标准品与真实样品间内酯环型和羧酸盐型分子的比例不一致; (2)不同时间点采集的样品中的2种形式喜树碱分子的比例不同; (3)抗喜树碱类小分子的抗体与开闭环喜树碱分子的反应性不同,产生不同水平的信号值。 在一个专题的预实验样品的分析中,得到的ADC的浓度数倍于总抗的浓度,明显受到了内酯环开闭的影响,见图9。 对于内酯环开闭的影响,解决方案是使用酸化策略,即先对样品和标准品进行酸化处理,使喜树碱分子都处于同样的闭环状态,然后进行中和处理,中和后的样品进入配体结合分析,我们将这种分析策略应用在所有的喜树碱类ADC药物的分析中。图10是酸化策略在两个喜树碱类ADC药物的应用示例,结果显示无论是单次给药还是多次给药,ADC的浓度均略小于总抗的浓度,且这种情况贯穿了研究的始终[11]。 PK分析方法受抗药抗体的影响 PK方法受ADA(Anti⁃drug antibody)的影响是较为常见的问题。ADA可以通过空间位阻影响分析方法中的抗体与药物的结合而影响PK分析方法的性能;如果是中和抗体,那么ADA会影响捕获抗原或独特型抗体与药物的结合,造成检测浓度降低。 图11中呈现的一个实例显示样品中的ADA既影响到TAb的分析结果也影响到ADC的分析结果。从2种方法的构建所涉及的关键试剂看,ADA对检测抗体的影响可能性较大,但对包被抗原和抗小分子抗体的影响也不能完全排除。 那么在什么情况下需要建立不受ADA影响的PK分析方法,关于这个问题,首先需要预测一下ADA耐受的PK方法是否能够提供更加关键和富含更多的信息。如果能够提供,那么需要去开发ADA耐受的方法。如果不能提供,需开发标准的PK方法,但要评估ADA对结果的影响情况。在获取PK、PD、ADA、毒理和药效数据的基础上,做PK的相关分析。分析药物水平与PK、PD、安全性和药效的相关性。如果相关,报告标准PK分析方法的分析结果;若不相关,那么在非临床研究中,要调查在大多数动物中,是否观察到早期或足够高的ADA发生率影响了初始的药物暴露特征/水平。在临床研究中,需关注发生不良反应ADA阳性受试者的药物暴露是否被低估。当药物暴露量与毒性或者药效不成比例时,比如暴露量小,但却呈现明显的毒性或者药效,这时需要考虑开发ADA耐受的PK分析方法[12]。 免疫原性域特异性分析的结果 会随分析模式的不同而异 对ADC的ADA域特异性的分析,通常可用2种方法: (1)表位竞争法; (2)表位标记法。 前者在桥接ADA方法中添加未标记的含域测试物,以消耗相应的抗药抗体,从而产生抑制信号;后者在桥接ADA方法中使用标记的含域测试物取代原来标记的药物分子,从而可以直接结合相应的抗药抗体,形成抗原夹心,产生阳性结合信号[13]。值得一提的是,使用表位竞争法时,ADA中针对次要表位的抗体会受到针对主要表位的抗体的影响而基本上不能被检测出来,但如果使用表位标记法进行检测的话,针对次要表位的抗体的检测基本上不受影响[13]。 ADA分析方法的药物耐受性不够 ADA方法经常遇到的问题是药物耐受性不高。游离药物会与抗药抗体结合而形成复合物,从而影响到ADA方法的检测,出现假阴性的结果。有多种技术手段可以改善ADA方法的药物耐受性,比如图12所列举的几种方法[14]。通常会有一种技术手段能够取得较好的效果。 常规使用BEAD(Bead extraction with acid disso⁃ciation)技术手段的ADA方法,即用固化有药物的磁性微球从酸解并中和的样品中提取ADA,再用桥接方法对ADA进行分析。图13显示这种技术手段在两种ADC药物的ADA分析方法中的药物耐受浓度在高水平ADA时(4000~8000ng·mL-1)可以超出1mg·mL-1,在低水平ADA时(100ng·mL-1)可达200μg·mL-1,基本上能够满足绝大部分的ADA分析的要求。 结语 ADC药物生物分析方法应当基于药物的特征进行开发,应对DAR值、药物的生物转化和分解代谢、ADA的影响等因素进行考虑,对分析方法进行优化。基于NMPA、FDA、以及EMA等相关指导原则[15⁃21],用于IND(investigational new drug application)、NDA(new drug application)、ANDA(abbreviated new drug application)和BLA(biologic license application)申报的非临床和临床研究,需对开发的生物分析方法进行验证。 开发的方法可能不是最佳方法,但应满足相关专题研究的需求,特别是在基质、灵敏度和相关的干扰以及药物耐受等方面满足要求。同时,应了解所采用分析方法的局限性,这有助于对所获得的数据进行准确分析、解读,也有助于后继方法的进一步改进。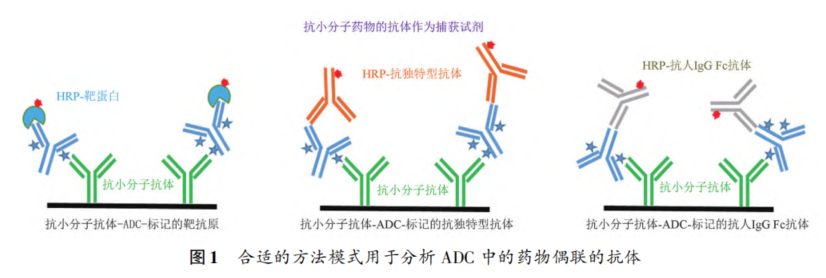

声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容