
2025-07-24 11:45:58来源:医药地理浏览量:2847
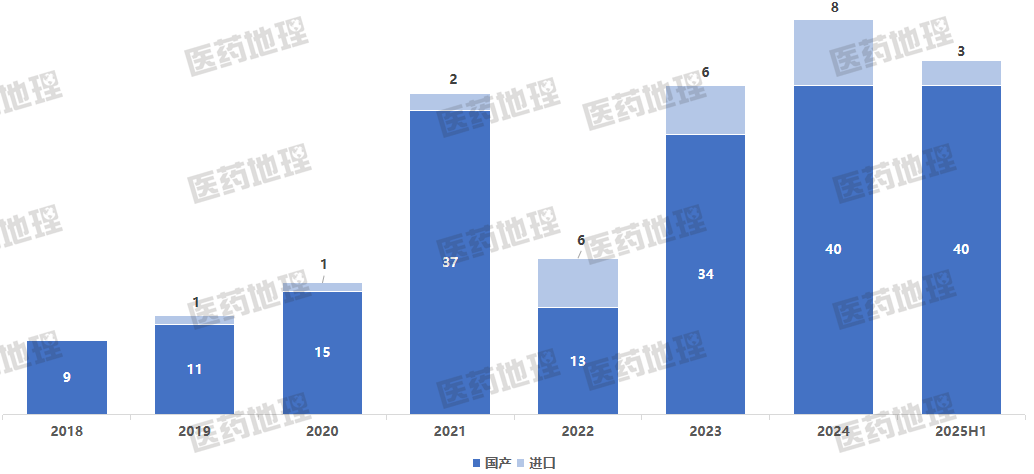
图1:2018-2025 H1中国获批上市的1类新药数量统计
数据来源:Pharma ONE药物研发大数据平台
从药物类型分布来看,化学药品以24个品种、56%的占比稳居首位;生物制品次之,共14个品种,占32%;中药及天然产物5个品种,占比12%。这一结构反映出现阶段我国新药研发仍以化学小分子为主导,但随着生物技术的快速迭代与中药现代化政策的持续推进,预计生物制品和天然药物在后续批件中的占比将逐步提升,产业格局有望有望由“单极主导”迈向“多元均衡”。
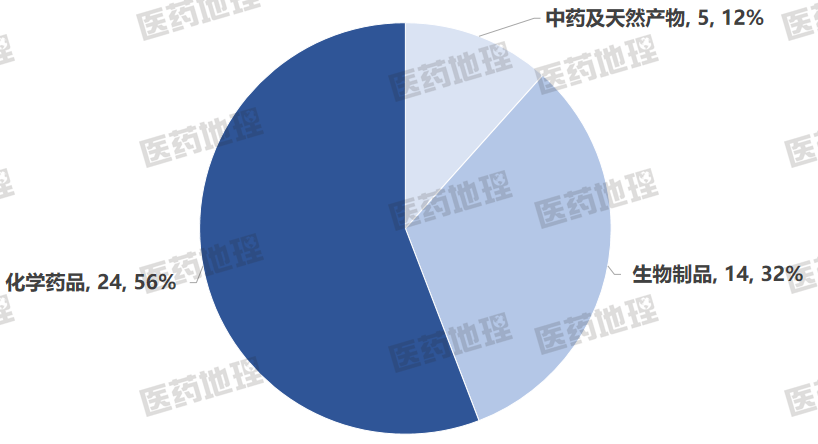
图2 2025 H1中国获批上市的1类新药类型分布
数据来源:Pharma ONE药物研发大数据平台
从治疗领域来看,2025年上半年NMPA批准的创新药呈现“一超多强”的格局:抗肿瘤药物以20个品种、47%的占比稳居首位,领先优势显著;抗感染药、中药和内分泌及代谢调节用药各5个品种,并列第二,均占比12%;骨骼与肌肉用药紧随其后,3个品种占7%;消化、血液及造血系统用药则各有2个品种获批,各占5%;心血管系统用药仅一个品种获批,占比2%,形成多点开花的态势。
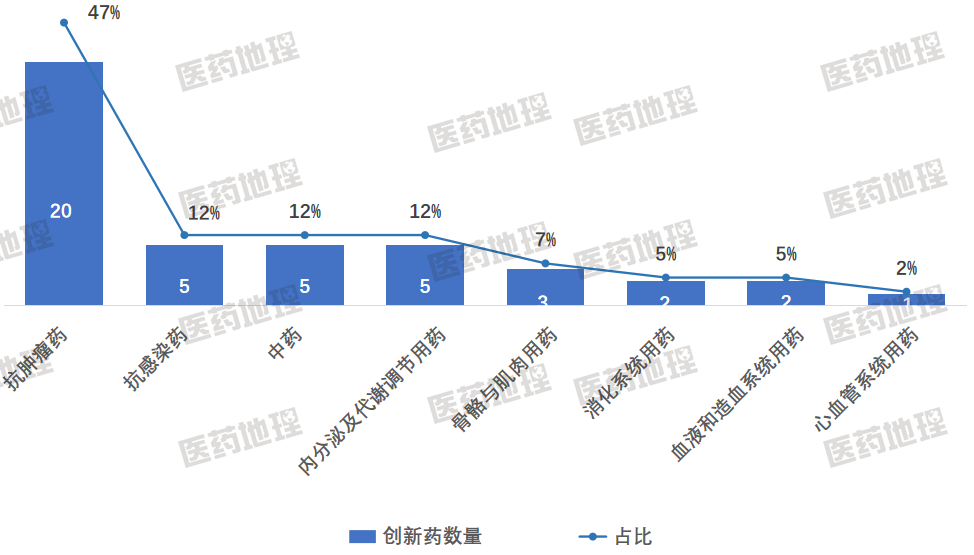
图3 2025 H1中国获批上市的1类新药治疗领域分布及占比
数据来源:Pharma ONE药物研发大数据平台
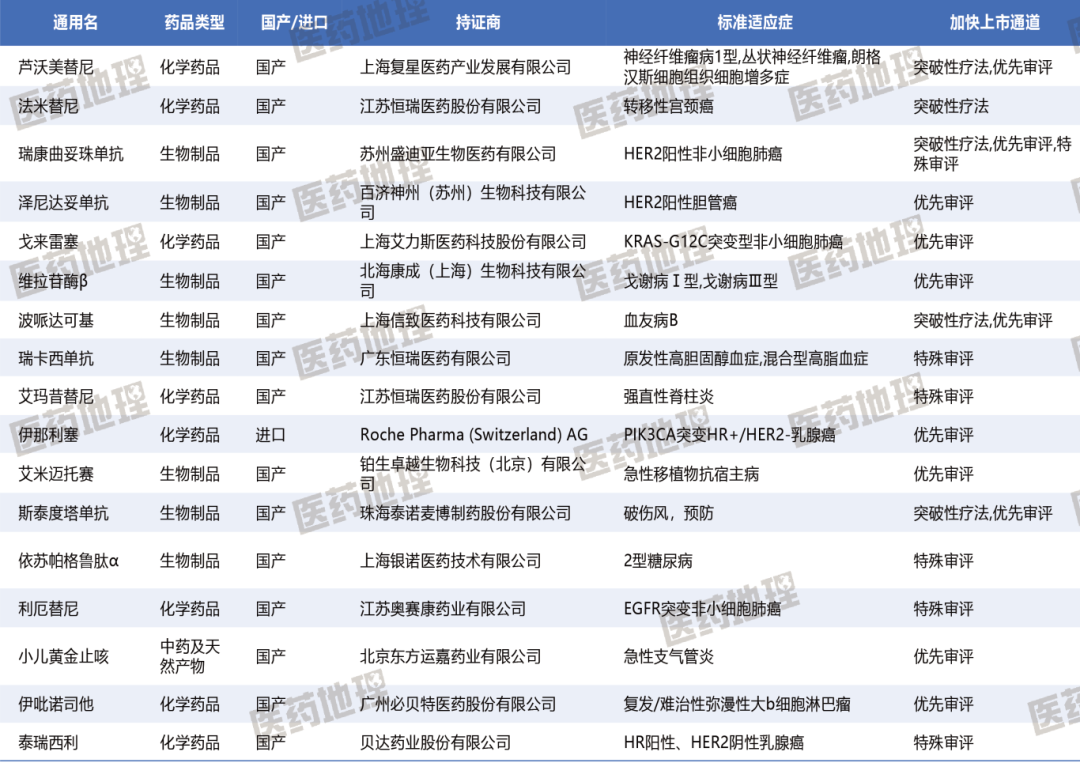
从审评角度来看,通过突破性疗法,优先审评/特殊审评的新药共有17款,占比约40%,涉及8款生物制品、8款化学药品和1款中药及天然产物。其中,芦沃美替尼、法米替尼、瑞康曲妥珠单抗、波哌达可基和斯泰度塔单抗5款药物获得CDE授予的突破性治疗药物称号。对企业而言,这既是荣誉,更是责任,后续确证性研究、真实世界证据与风险获益比的动态评估,将决定这些“突破性”光环最终能否转化为患者生存获益与市场长期价值。
表1 2025 H1加快上市通道的1类新药 数据来源:Pharma ONE药物研发大数据平台
● 芦沃美替尼片(商品名:复迈宁)
芦沃美替尼是上海复星医药旗下一种高选择性MEK1/2口服小分子抑制剂,通过阻断MAPK信号通路的异常激活,抑制肿瘤细胞增殖并诱导其凋亡。目前芦沃美替尼已通过国家药品监督管理局优先审评审批程序,于5月29日获批用于治疗朗格汉斯细胞组织细胞增生症(LCH)和组织细胞肿瘤成人患者;以及2岁及2岁以上伴有症状、无法手术的丛状神经纤维瘤(PN)的I型神经纤维瘤病(NF1)儿童及青少年患者,是中国首个且目前唯一拥有上述双适应症的药物。此外,芦沃美替尼用于儿童LCH的适应症也已被国家药监局药品审评中心纳入突破性治疗药物程序。
●苹果酸法米替尼胶囊(商品名:艾比特)
法米替尼是恒瑞医药自主研发的小分子多靶点酪氨酸激酶抑制剂,研究结果表明,苹果酸法米替尼联合卡瑞利珠单抗可提高患者的客观缓解率和无进展生存期,并且可延长复发转移性宫颈癌患者的总生存期。最新的亚组分析显示,对于既往未接受过贝伐珠单抗治疗的受试者,苹果酸法米替尼与卡瑞利珠单抗联合治疗的抗肿瘤疗效优于卡瑞利珠单抗单药(ORR 44.6% vs. 22.6%),且苹果酸法米替尼与卡瑞利珠单抗联合治疗的mPFS达到6.4个月,延长mOS达20.2个月。安全性方面,苹果酸法米替尼与卡瑞利珠单抗联合治疗未增加新的不良反应谱。该靶免联合疗法重磅获批,是宫颈癌治疗领域的一个重大里程碑,为复发或转移性宫颈癌患者开辟了新的治疗途径。
●瑞康曲妥珠单抗 (SHR-A1811,商品名:艾维达)
注射用瑞康曲妥珠单抗是苏州盛迪亚生物医药有限公司旗下药品,适用于治疗存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。最新研究数据显示,瑞康曲妥珠单抗治疗既往经治的HER2突变晚期或转移性NSCLC中位随访时间已达14.2个月,独立评审委员会评估的客观缓解率(ORR)则达74.5%。其中位无进展生存期(mPFS)达11.5个月,较传统疗法提升近2倍,同时显著降低传统ADC的毒性风险。这项突破性成果于2025年2月发表于《柳叶刀·肿瘤学》,也在2025年美国癌症研究学会年会上亮相。
●伊那利塞片(商品名:伊赫莱)
伊那利塞是由罗氏制药研发的高选择性PI3Kα抑制剂及突变体降解剂,适用于HR阳性/HER2阴性、PIK3CA突变的局部晚期或转移性乳腺癌成人患者。该药物通过抑制PI3Kα信号通路和降解突变型蛋白的双重机制发挥抗肿瘤作用,2024年10月获美国FDA批准,2025年3月14日获中国国家药监局批准上市。作为中国首个获批的同类药物,其联合CDK4/6抑制剂与内分泌治疗方案,为内分泌治疗耐药患者提供精准治疗选择。
站在2025年中回望,43张“1类”新药批件不仅刷新了历史同期纪录,更像一面镜子,照出中国创新药生态的三重跃迁:监管科学与国际同步、技术路线由小分子单极走向“化药-生物药-中药”三足鼎立、临床需求由“跟跑”转向“首创”。当抗肿瘤、内分泌、罕见病等关键赛道多点开花,当突破性疗法成为常态而非特例,我们有理由乐观,但更应冷静——真正的考验不在获批时刻,而在于上市后能否持续交付让真实世界获益,能否凭借循证医学把“首创”变成“金标准”。下一阶段,企业需把资源从“抢第一张证”转向“做深全生命周期证据链”,投资机构也应从“估值故事”回归“患者结局”。唯有如此,中国创新药才能从审批高峰走向临床高峰,最终在全球价值链上完成从“参与者”到“定义者”的质变。
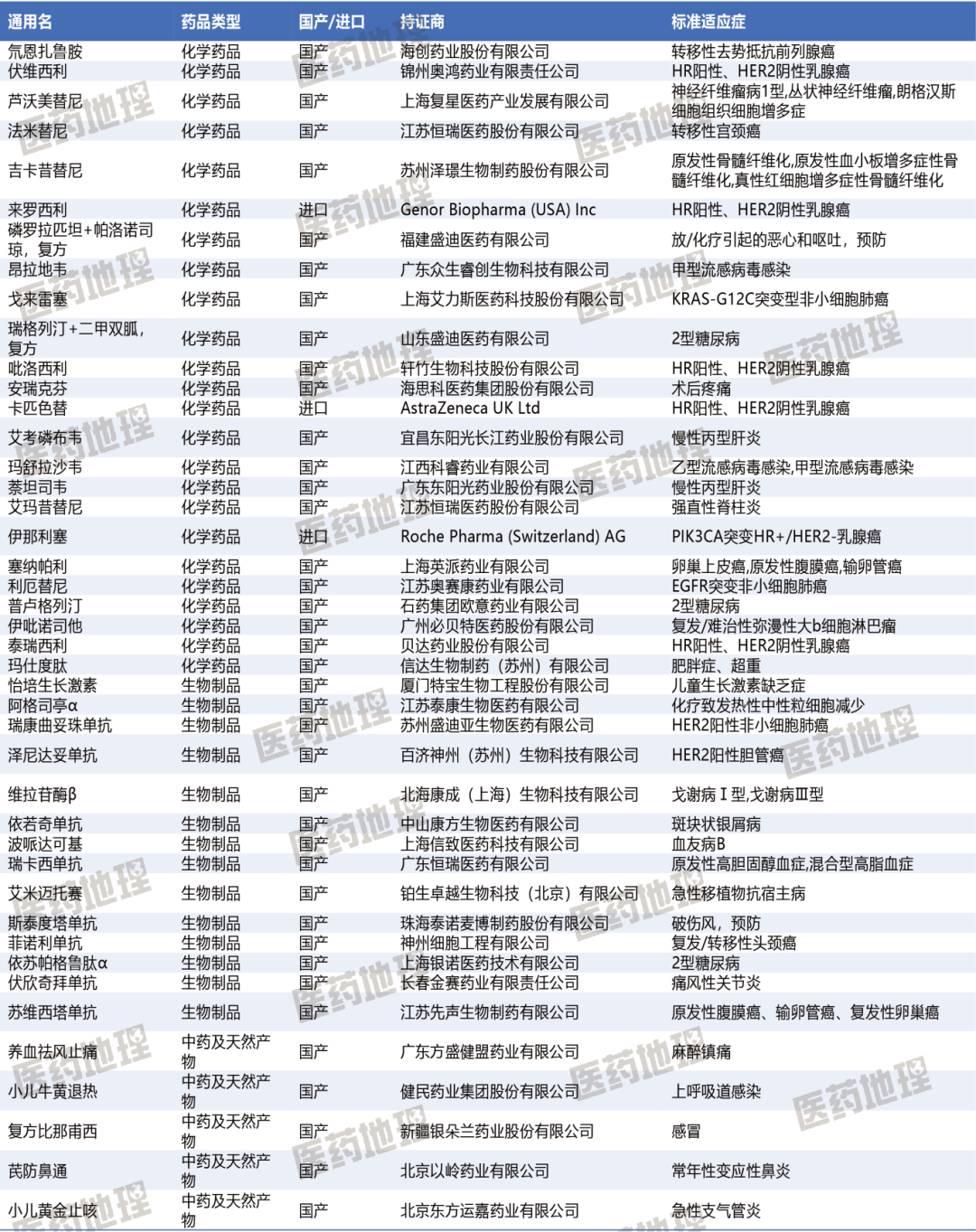
附表:2025 H1中国获批上市43个的1类新药汇总 数据来源:Pharma ONE药物研发大数据平台
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容