2025-09-23 10:37:06来源:注册圈 浏览量:662
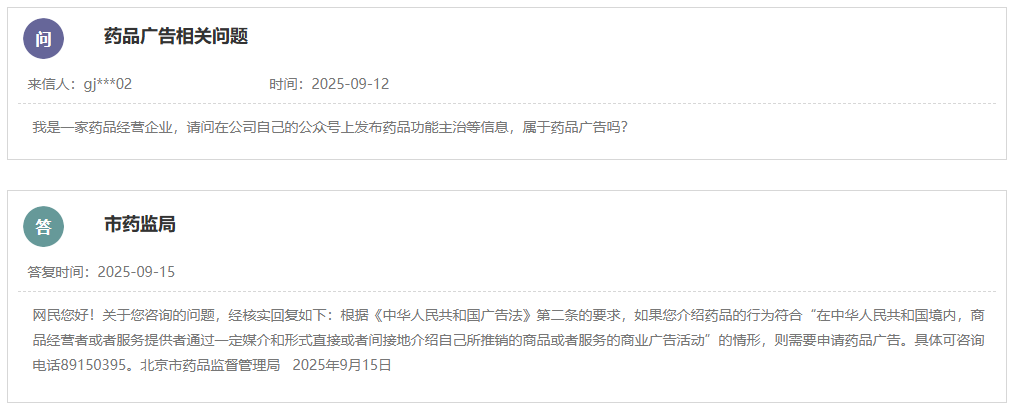
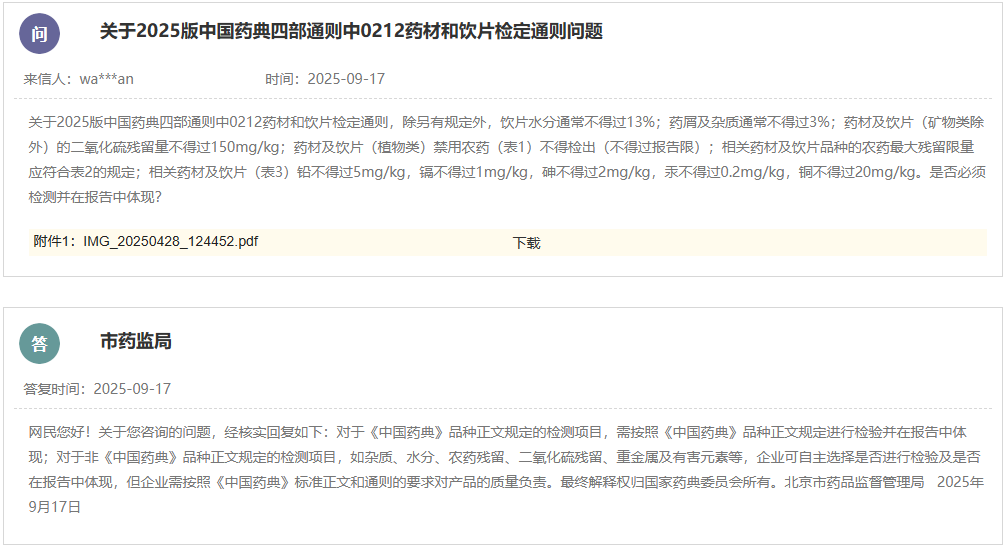
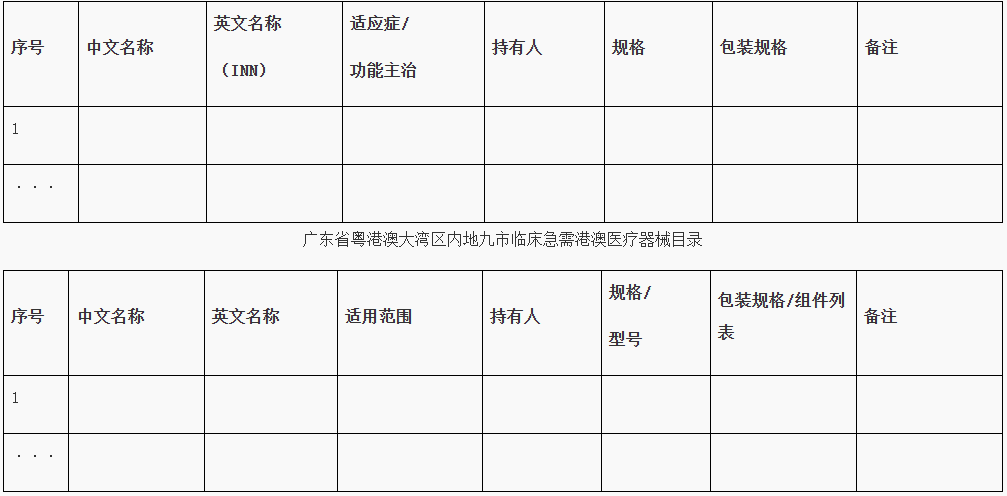
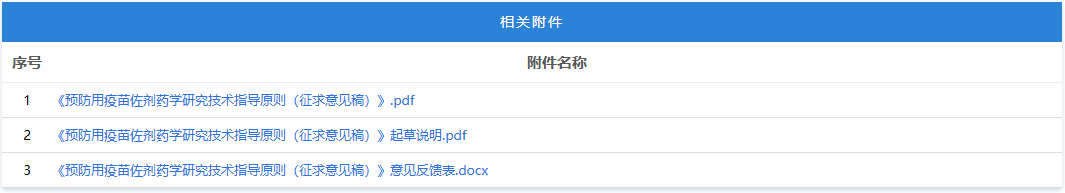
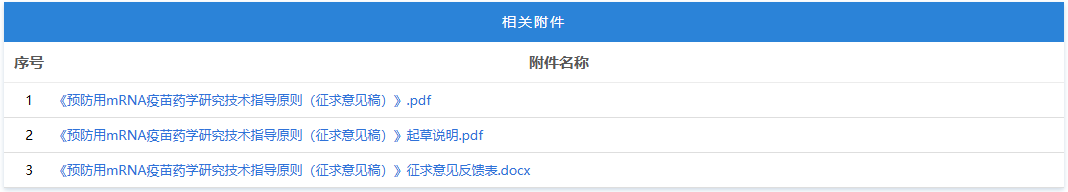
https://www.cde.org.cn/main/news/viewInfoCommon/2b276fc75b071bbab7be1865b41b9468 为更好地指导含新型佐剂疫苗的研究与评价,促进新型佐剂以及创新佐剂疫苗的研发,经广泛调研和讨论,我中心组织起草了《预防用疫苗佐剂药学研究技术指导原则(征求意见稿)》。 我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。 请将您的反馈意见发到以下联系人的邮箱: 联系人:郭胜楠、金苏 联系方式:guoshn@cde.org.cn、jins@cde.org.cn 感谢您的参与和大力支持。 国家药品监督管理局药品审评中心 2025年9月16日 https://www.cde.org.cn/main/news/viewInfoCommon/f15fd0a55f717a4d6f025b3174811b99 依据《儿童抗肿瘤药物研发鼓励试点计划(星光计划)申报指南》,现将ICP-723口崩片纳入“星光计划”,试点项目的基本信息如下: 品种名称:ICP-723口崩片 申报单位:北京诺诚健华医药科技有限公司拟开发儿童适应症:携带神经营养酪氨酸受体激酶(NTRK)融合基因的实体瘤 国家药品监督管理局药品审评中心 2025年9月16日 https://www.cde.org.cn/main/news/viewInfoCommon/14fe17c4cafcd0e1cd2a3c7710790a39 为鼓励、规范和指导预防用mRNA疫苗的研发,经广泛调研和讨论,我中心起草了《预防用mRNA疫苗药学研究技术指导原则(征求意见稿)》,现公开征求意见。 我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈我们,以便后续完善。征求意见时限为自发布之日起1个月。 您的反馈意见请以征求意见反馈表形式发送至以下联系人的邮箱: 联系人:杨丹、胡琳 联系方式:yangdan@cde.org.cn,hul@cde.org.cn 感谢您的参与和大力支持。 国家药品监督管理局药品审评中心 2025年9月16日 https://www.cde.org.cn/main/news/viewInfoCommon/78e8a476209c52c1dd9df3c2cd1a15d2 根据国家局2019年3月28日发布的《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号),我中心组织遴选了第九十八批参比制剂(见附件),现予以公示征求意见。 公示期间,请通过参比制剂遴选申请平台下“参比制剂存疑品种申请”模块向药审中心进行反馈,为更好服务申请人,反馈意见请提供充分依据和论证材料,反馈材料应加盖单位公章,并提供真实姓名和联系方式。 公示期限:2025年9月17日~2025年9月30日(10个工作日)。 国家药品监督管理局药品审评中心 2025年9月17日 https://www.cde.org.cn/main/news/viewInfoCommon/e187803249f3a7de0a945741fa2b94c4 《ICH E2F:研发期间安全性更新报告指导原则》自2019年11月5日正式实施以来,来自申请人之窗的一般性技术问题咨询和其他咨询通道中收集到的问题逐渐增多。为进一步指导申办者规范撰写并递交符合ICH E2F和中国区域实施要求的DSUR,指导原则工作组经过系统梳理,就比较集中的共性问题进行讨论,现形成了《研发期间安全性更新报告常见问答(征求意见稿)》。 我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起一个月。 您的反馈意见请发到以下联系人的邮箱: 联系人:姚珠星,崔欢欢 联系方式:yaozhx@cde.org.cn, cuihh@cde.org.cn, 感谢您的参与和大力支持。 国家药品监督管理局药品审评中心 2025年9月17日 https://www.cde.org.cn/main/news/viewInfoCommon/5c7dd59364f4ba08adcb3a5e54e51a06 为加强对于CAR-T细胞治疗产品说明书的管理,促进说明书撰写的规范性和持续完善,我中心组织起草了《嵌合抗原受体T细胞说明书临床相关信息撰写指导原则(征求意见稿)》。 我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。 您的反馈意见请发到以下联系人的邮箱: 联系人:赵晨阳、王晶 联系方式:zhaochy@cde.org.cn, wangjing01@cde.org.cn。 感谢您的参与和大力支持。 国家药品监督管理局药品审评中心 2025年9月17日 https://www.cde.org.cn/main/news/viewInfoCommon/ec4d30531a89cad6978acd836de5ed52 近年来,随着多模式镇痛和减少阿片类药物使用理念的推广,用于术后镇痛的长效局部麻醉药的改良研发日渐增多,为规范此类药物的临床试验设计,提高研发的质量与效率,我中心起草了《用于术后镇痛的长效局部麻醉药临床试验技术指导原则(征求意见稿)》。 我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起一个月。 您的反馈意见请发到以下联系人的邮箱: 联系人:丛端端 联系方式:congdd@cde.org.cn 感谢您的支持。 国家药品监督管理局药品审评中心 2025年9月18日 https://www.cde.org.cn/main/news/viewInfoCommon/2676e243499c7d7bf4bf18e355a6f40e 根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。 特此通告。 附件:重组腺相关病毒载体类体内基因治疗产品申报上市药学共性问题与技术要求 国家药监局药审中心 2025年9月8日 https://www.cde.org.cn/main/news/viewInfoCommon/1cebc04d1db7f210d533b2abe6fe13a7 为贯彻落实国务院办公厅《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》(国办发〔2024〕53号)部署,结合药物研发与技术审评沟通交流工作实际,我中心深入研究,现形成了《药物研发与技术审评沟通交流管理办法(2025年版)》(征求意见稿)。 我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时间为自发布之日起一个月。请将您的反馈意见发到以下联系人的邮箱:wangjunjie@cde.org.cn 感谢您的参与和大力支持。 国家药品监督管理局药品审评中心 2025年9月19日 十、国家药监局药审中心关于发布《中药注册受理审查指南(试行)》的通告(2025年第41号) 网址: https://www.cde.org.cn/main/news/viewInfoCommon/97bcc03effc837014b6ba78b197235f4 为进一步规范中药注册受理的形式审查要求,更好地指导和服务申请人,在国家药品监督管理局的部署下,药审中心组织修订了《中药注册受理审查指南(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自2025年10月15日起施行。 特此通告。 附件:中药注册受理审查指南(试行) 国家药监局药审中心 2025年9月18日 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/zhybhpzh/zhybhpzhgg/20250915165955131.html 根据《中药品种保护条例》第十六条及有关规定,经国家中药品种保护审评委员会组织的委员审评,国家药监局核准: 对南昌弘益药业有限公司的灯盏花素滴丸继续给予二级保护,其保护期限、保护品种编号分别为:2025年9月10日—2032年2月25日、ZYB20720250230。 特此公告。 二、国家药监局关于发布YY/T 1987—2025《采用脑机接口技术的医疗器械 术语》医疗器械行业标准的公告(2025年第91号) 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxhybzhgg/20250916160311166.html YY/T 1987—2025《采用脑机接口技术的医疗器械 术语》医疗器械行业标准已经审定通过,现予以公布。标准编号、标准名称、适用范围和实施日期见附件。 特此公告。 附件:医疗器械行业标准信息表 国家药监局 2025年9月15日 三、国家药监局关于批准注册263个医疗器械产品的公告(2025年8月)(2025年第90号) 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxpzhzhcchpgg/20250916173151127.html 2025年8月,国家药监局共批准注册医疗器械产品263个。其中,境内第三类医疗器械产品208个,进口第三类医疗器械产品31个,进口第二类医疗器械产品22个,港澳台医疗器械产品2个(具体产品见附件)。 特此公告。 附件:2025年8月批准注册医疗器械产品目录 国家药监局 2025年9月12日 https://www.nifdc.org.cn/nifdc/xxgk/ggtzh/gonggao/202509151340191724324.html 按照《国家药监局综合司关于印发〈GB 9706.1—2020及配套并列标准、专用标准实施工作方案〉的通知》要求,为摸清底数,中检院统计了截至2025年9月1日,76个新版GB 9706系列标准检验资质认定情况和GB 9706.1—2020、YY9706.102—2021获证机构信息(见附件)。 现对上述信息予以公告,供各相关单位参考,以加快推进新版GB 9706系列标准实施。 更多详情请访问国家市场监管总局检验检测机构资质认定网上审批系统“资质认定获证机构能力查询”平台: http://cma.cnca.cn/cma/solr/tBzAbilitySearch/list。 附件:新版GB 9706系列标准检验资质认定有关情况(2025年9月) 中检院 2025年9月15日 一、山东省药品监督管理局 (一)关于公开征求《山东省药品现代物流企业实施意见(征求意见稿)》意见的通知 网址: http://mpa.shandong.gov.cn/col/col101797/art/2025/art_249b537e1e194e8397bd41ce44fc64a1.html 各有关单位: 为深入贯彻落实《中华人民共和国药品管理法》《药品经营和使用质量监督管理办法》(国家市场监督管理总局令第84号)等要求,进一步规范我省药品现代物流企业及第三方物流企业的质量管理活动,促进药品流通行业高质量发展,保障公众用药安全,结合我省实际,我局组织起草了《山东省药品现代物流企业实施意见(征求意见稿)》,现公开征求各有关单位意见。请填写征求意见反馈表(附件3),于2025年10月16日前反馈至电子邮箱ypscc@shandong.cn,邮件主题请注明“山东省药品现代物流企业实施意见(征求意见稿)的意见反馈”。 附件1 山东省药品现代物流企业实施意见(征求意见稿).docx 附件2 山东省药品现代物流企业实施意见(征求意见稿)起草说明.docx 附件3 山东省药品现代物流企业实施意见(征求意见稿) 征求意见反馈表.docx (二)媒体解读:山东省三部门联合推动药品经营使用环节全品种信息化追溯体系建设 网址: http://mpa.shandong.gov.cn/col/col267475/art/2025/art_1dd26ba4ed854f60a44f8b16e125f80e.html 中国食品药品网讯 近日,山东省药监局、山东省卫生健康委、山东省医保局三部门联合印发《山东省药品经营使用环节全品种信息化追溯体系建设及药品追溯码采集应用工作方案》(以下简称《工作方案》),进一步提升药品追溯精准监管,督促和指导药品经营企业、医疗机构高效开展追溯工作,保障公众用药安全和医保基金合理使用。 《工作方案》在工作目标中提出,通过推进“一物一码、物码同追”,依托药品上市许可持有人的药品追溯系统和全国统一的医保信息平台,逐步实现全省药品经营企业、医疗机构追溯码规范采集应用全覆盖和药品全品种流通、使用环节可追溯,保障公众用药安全和医保基金合理使用。 《工作方案》明确了药品经营环节落实药品追溯的三个工作节点:2025年11月1日起,鼓励和支持药品批发企业、零售连锁总部及其门店、一级及以上医疗机构率先实现全品种扫码追溯工作;2026年1月1日起,全省在营药品批发企业、药品零售连锁总部、零售药店、医疗机构开展全部在售品种入出库扫码和数据上传工作;2027年全省赋码药品实现全品种可追溯,形成互联互通的药品追溯数据链。 《工作方案》分别对药品批发企业及零售连锁总部、零售药店、医疗机构提出管理要求,鼓励其通过软件融合或安装插件、硬件升级的方式提高追溯数据录入的便捷性、规范性和准确性;要求药品追溯系统运营单位完善建设和运营管理,及时准确向监管部门提供全品种全链条追溯信息并配合监督检查、案件查办、事件处置工作。 《工作方案》明确了各级药监、卫健、医保部门的具体职责,并要求三方加强组织领导、加强日常监管及宣贯培训,充分发挥“三医”联动机制作用,加强追溯数据共享和互联互通,促进医疗、医保、医药协同发展和治理,形成药品安全治理工作合力。《工作方案》还要求药品经营企业和医疗机构全面落实主体责任,指定专门机构和人员负责药品信息化追溯体系建设,发现违法违规线索时主动向监管部门报告,确保追溯信息准确、追溯链条畅通。 二、北京市药品监督管理局 (一)北京市药品监督管理局等14部门关于调整 北京市高风险特殊物品入境联合监管 ,工作小组成员单位的公告 网址: https://yjj.beijing.gov.cn/yjj/zwgk20/gg17/743758327/index.html 根据市委市政府工作部署,为贯彻落实《支持北京深化国家服务业扩大开放综合示范区建设工作方案》,充分落实《北京市高风险特殊物品入境联合监管机制工作试点方案》,积极扩大试点效应,经北京市高风险特殊物品入境联合监管工作小组(以下简称工作小组)联席会议决定,增加中关村科学城管理委员会为工作小组成员单位。 新增单位依照《北京市高风险特殊物品入境联合监管机制工作试点方案》,负责接收试点单位和试点物品申报材料并提交机制办公室;与海关及其他市级相关部门协同联动,配合落实区域内试点单位和试点物品的事中事后监管,防止出现监管脱节、缺位。 特此公告。 北京市药品监督管理局 北京市科学技术委员会: 中关村科技园区管理委员会 (北京市科学技术委员会代章) 北京市经济和信息化局北京市公安局 北京市生态环境局 北京市商务局 北京市交通委员会 北京市卫生健康委员会 北京市市场监督管理局中华人民共和国北京海关 北京经济技术开发区管理委员会北京首都国际机场临空区管理委员会北京大兴国际机场临空经济区联合管理委员会中关村科学城管理委员会 2025年9月9日 (二)新增2个共性问答 网址: https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/bjah-index-dept!detail.action?originalId=AH25091200681 三、广东省药品监督管理局 (一)“东省药品监督管理局 广东省卫生健康委员会关于印发《广东省粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录管理办法》的通知 网址: http://mpa.gd.gov.cn/zwgk/gzwj/content/post_4772815.html 广州、深圳、珠海、佛山、惠州、东莞、中山、江门、肇庆市市场监督管理局、卫生健康局(委),横琴粤澳深度合作区商事服务局、民生事务局: 现将《广东省粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录管理办法》印发给你们,请认真贯彻执行。遇有问题和新情况,请及时向广东省药品监督管理局、广东省卫生健康委员会等部门反映。 广东省药品监督管理局 广东省卫生健康委员会 2025年8月27日 广东省粤港澳大湾区内地九市临床急需 进口港澳药品医疗器械目录管理办法 第一条 为规范粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录管理,满足粤港澳大湾区居民用药用械需求,保障用药用械安全,根据《广东省粤港澳大湾区内地九市进口港澳药品医疗器械管理条例》,制定本办法。 第二条 本办法所称临床急需进口港澳药品医疗器械(以下简称急需港澳药械)是指大湾区内地九市指定医疗机构进口使用的临床急需、已在港澳上市的药品,以及港澳公立医院已采购使用、属于临床急需、具有临床应用先进性的医疗器械。 第三条 急需港澳药械目录的制定、公布及调整,应当以临床需求为导向,坚持科学、公正、公开、透明的原则,实施动态调整并及时向社会公布。 第四条 广东省药品监督管理局负责急需港澳药械目录管理制度的建立、实施及解释工作。 广东省药品监督管理局、广东省卫生健康委员会根据临床需求和药品医疗器械上市、使用情况,制定急需港澳药械目录。 广东省药品监督管理局审评认证中心组织急需港澳药械目录品种的评审工作,并建立健全评审工作的相关制度。 广东省药品不良反应监测中心承担全省急需港澳药械的不良反应/事件报告和监测的技术工作。 第五条 广东省药品监督管理局应当与港澳卫生、药品监管部门建立健全急需港澳药械目录管理协作机制,加强急需港澳药械上市或使用情况、不良反应/事件等监督管理信息共享,及时调整急需港澳药械目录。 第六条 广东省药品监督管理局建立粤港澳大湾区内地临床急需进口港澳药品医疗器械预审品种数据库(以下简称预审库),用于急需港澳药械品种信息的收集。 第七条 药品、医疗器械上市许可持有人或者其授权的在中国境内的企业法人(以下简称填报人)可以按要求填报拟纳入急需港澳药械评审范围的品种信息,并上传相关资料。品种填报并成功提交后即纳入预审库。 填报人提交资料不符合要求的,广东省药品监督管理局审评认证中心可以通知填报人补充相关资料或者予以退库。 第八条 除符合本办法第二条规定外,纳入急需港澳药械目录范围的药械,应当符合以下要求之一: (一)国家药品监督管理局已发布的临床急需境外药械品种且在港澳已上市的; (二)已纳入预审库、属于罕见病、创新药械、儿童用药械等符合临床急需、具有临床应用先进性的品种; (三)已获得临床急需进口港澳药械批件的; (四)其他符合国家规定的急需港澳药械。 第九条 以下品种不纳入急需港澳药械目录范围: (一)明确存在严重安全风险的; (二)违背国家法律、法规,或者不符合伦理要求的; (三)其他不符合国家规定的急需港澳药械。 第十条 广东省药品监督管理局审评认证中心按照本办法第八条的要求,定期审核汇总预审库品种,及时组织专家进行评审。经评审符合要求的,广东省药品监督管理局审评认证中心出具审评意见,报广东省药品监督管理局会广东省卫生健康委员会纳入急需港澳药械目录。 急需港澳药械目录包括药品医疗器械名称、规格/型号、持有人、适应症/适用范围等信息。 第十一条 广东省药品监督管理局会同广东省卫生健康委员会建立急需港澳药械评审专家库。广东省药品监督管理局审评认证中心依照《粤港澳大湾区内地临床急需进口港澳药品医疗器械使用评审专家库管理办法(试行)》等相关规定,落实专家遴选、日常维护、增补调整、费用支付等工作。 评审专家应当在医药相关领域从业人员中从优选择。一般由省内药品医疗器械相关技术单位、省内医疗卫生机构、高等院校等推荐,主要涉及医疗机构药学专家、医疗机构临床医学专家、医疗机构管理专家、高等院校专家教授、药品医疗器械技术专家、医药行业学(协)会专家等。 第十二条 制定和调整急需港澳药械目录,应当听取政府有关部门、行业协会、医疗机构、药品医疗器械经营企业以及社会公众等方面的意见。 第十三条 广东省药品监督管理局会同广东省卫生健康委员会公布急需港澳药械目录,供医疗机构、公众和相关部门查询。 第十四条 广东省药品监督管理局会同广东省卫生健康委员会对急需港澳药械目录实施动态调整。 有以下情形之一的,应当实时调出急需港澳药械目录: (一)已在中国内地获批上市的药品医疗器械; (二)港澳批准文件已注销的药品或者港澳公立医院不再采购使用的医疗器械; (三)经广东省药品监督管理局会同广东省卫生健康委员会评估,药品医疗器械不再具备临床急需性或者临床应用先进性的; (四)发现药品医疗器械存在使用安全问题,或者在临床使用中出现可疑且非预期严重不良反应以及其他潜在严重安全风险,造成严重医疗事故的; (五)发现药品医疗器械纳入急需港澳药械目录申请过程中,存在提供虚假的证明、数据、资料或者采取其他手段骗取纳入急需港澳药械目录管理的; (六)药品、医疗器械上市许可持有人或者其授权的在中国境内的企业法人主动申请调出的; (七)其他不符合国家规定的急需港澳药械。 第十五条 广东省药品不良反应监测中心应当对收集到的急需港澳药械境内外不良反应/事件进行分析评价,认为存在安全性风险的,应当及时研判,必要时可以召开专家评估会,及时向广东省药品监督管理局提交评价意见。 广东省药品监督管理局收到评价意见后,如经评估确需调出目录的,会同广东省卫生健康委员会对急需港澳药械目录实施调整。 第十六条 指定医疗机构申请进口使用急需港澳药械目录外品种,经广东省卫生健康委员会、广东省药品监督管理局核发批件后,该品种同步纳入急需港澳药械目录。 第十七条 本办法自2025年11月1日起施行,有效期5年。 附件 广东省粤港澳大湾区内地九市临床急需港澳药品目录 (二)《广东省粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录管理办法》政策解读 网址: http://mpa.gd.gov.cn/zwgk/gzwj/content/post_4772835.html 为贯彻落实《粤港澳大湾区发展规划纲要》《粤港澳大湾区药品医疗器械监管创新发展工作方案》等文件精神,更好满足粤港澳大湾区居民用药用械需求,保障用药用械安全,根据《广东省粤港澳大湾区内地九市进口港澳药品医疗器械管理条例》(下称《条例》)的规定,广东省药品监督管理局联合广东省卫生健康委员会联合印发《广东省粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录管理办法》(下称《办法》),将于2025年11月1日起施行。 一、《办法》出台的背景和意义 一是贯彻落实《条例》,更好地满足粤港澳大湾区居民用药用械需求的必备文件。党的十八大以来,以习近平同志为核心的党中央始终坚持人民至上、生命至上。习近平总书记在二十届三中全会及多次讲话中指出,要“实施健康优先发展战略”“把保障人民健康放在优先发展的战略位置”。为满足粤港澳大湾区居民对急需药械的临床需求,国务院授权广东省人民政府批准临床急需、已在港澳上市的药品及港澳公立医院已采购使用、具有临床应用先进性的医疗器械(简称“港澳药械通”)。“港澳药械通”立足粤港澳大湾区居民用药用械需求,解决港澳先进药械不能尽快在境内注册上市的困境,实现“小切口”服务“大民生”,大大提高急需药械可及性。为解决“港澳药械通”政策执行以来存在急需港澳药械目录遴选时效不及时、遴选工作被动、调整机制不明确等问题,《条例》规定对急需港澳药械实行目录管理,省人民政府药监部门应当建立急需港澳药械目录管理制度,同时规定了目录内和目录外急需港澳药械进口审核流程。制定《办法》是贯彻《条例》规定的需要,是明确急需港澳药械目录管理机制、提升目录管理效率、更好地满足粤港澳大湾区居民用药用械需求的必备文件。 二是完善粤港澳大湾区药械创新监管体系的重要举措。2020年9月,国家市场监管总局等八部委联合印发了《粤港澳大湾区药品医疗器械监管创新发展工作方案》,广东省作为改革开放的排头兵、先行地,持续推进粤港澳大湾区药械监管创新发展工作,不断探索建立粤港澳三地药械合作新模式,提升药械监管体系和监管能力现代化水平。《办法》作为《条例》实施的重要配套文件,其发布对于完善“港澳药械通”创新监管体系,优化“港澳药械通”的实施具有重要作用。在急需港澳药械目录管理中,需要充分发挥粤港澳三地药监、卫生等部门之间的沟通交流与协作,是对完善粤港澳大湾区药械监管协作机制的进一步探索与实践,对于实现粤港澳区域一体化发展,纵深推进粤港澳大湾区建设意义深远。 三是推动粤港澳大湾区医药产业高质量发展的关键动力。《办法》将实现“港澳药械通”品种遴选更加规范化、体系化、制度化,加快港澳先进药械进入临床使用的效率,促使更多先进药械引进粤港澳大湾区,规范开展真实世界研究,提升医疗机构的临床研究水平及诊治能力,整合医疗卫生资源,推动粤港澳大湾区医疗服务的整体提升。同时,也将吸引全球跨国药械企业关注粤港澳大湾区,将“港澳药械通”作为进入境内市场的“敲门砖”,促进创新药械在大湾区的集聚发展,进一步推动粤港澳大湾区药械监管创新与发展,推进广东省生物医药事业高质量发展。 二、《办法》的主要内容 一是明确急需港澳药械目录运行机制,满足居民用药用械需求。第二条明确急需港澳药械的适用范围。第三条规定,坚持以临床需求为导向,明确急需港澳药械目录的制定、公布及调整的原则。第四条厘清有关部门及技术支撑机构的职责。第五条建立急需港澳药械目录管理协作机制,加强监督管理信息共享。第六条建立预审库制度,用于收集急需港澳药械品种信息。 二是明确急需港澳药械目录遴选公布机制,实现急需港澳药械的可及。第七条明确收集产品信息及制定程序,规定填报人可按要求上传材料及审评认证中心组织审核的职责。第八、九条明确遴选范围和负遴选范围,从安全风险、违背国家法律法规及伦理要求上进行考量。第十条按照遴选范围要求,制定评审程序。第十一条建立评审专家库,优先选择医药相关领域从业人员。第十二条规定,在制定和调整急需港澳药械目录时,应向有关部门征集意见。第十三条明确目录公布的机构,规定公布的目录可供医疗机构、公众及相关部门查询。 三是明确急需港澳药械目录动态调整机制,保障居民用药用械安全。第十四条规定,对急需港澳药械目录实施动态调整。第十五条规定,广东省药品不良反应监测中心应对急需港澳药械警戒信息进行分析评价,及时提交评价意见。第十六条规定,申请进口使用目录外品种,经有关部门核发批件后,可同步纳入急需港澳药械目录。









一、关于新版GB 9706系列标准检验资质认定有关情况的公告(2025年9月)
网址: