
2025-09-24 00:00:00来源:https://www.chemicalbook.com/SupplierNews_359462.htm浏览量:577
CMC(Chemistry, Manufacturing, and Controls)是新药研发中决定项目能否顺利推进的核心支撑环节。它不仅是药学研究的基础,更是监管申报中数据最密集、技术要求最严格的模块之一。一个扎实的CMC开发策略,能有效支撑从IND到NDA的全过程。
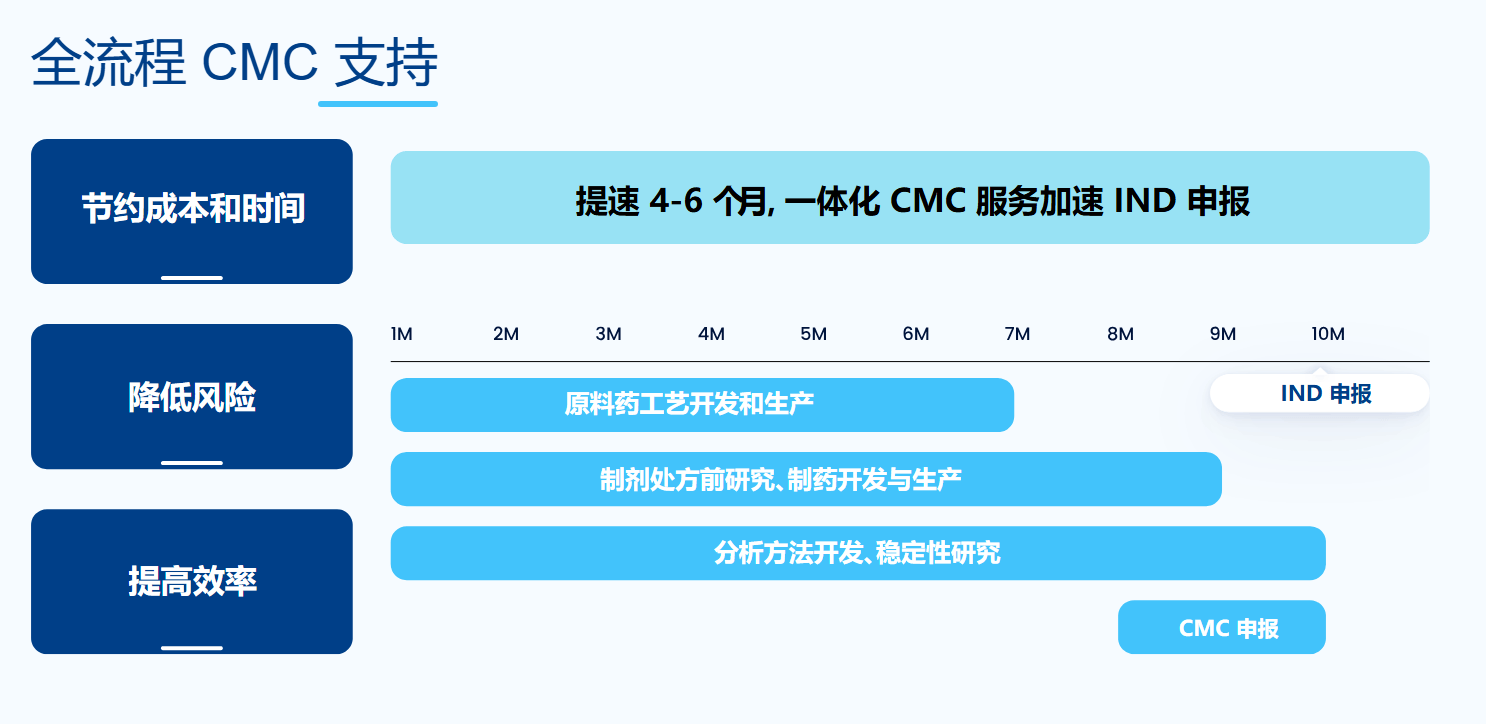
一、CMC的核心构成与技术要求
以小分子化药为例,CMC工作需覆盖以下具体模块:
原料药(API):明确合成路线(如6步合成法),识别关键中间体,建立起始物料质量标准。例如,某API中残留溶剂甲苯需控制在≤3000 ppm,须通过顶空GC法验证。
制剂开发:完成处方筛选(如对比乳糖、微晶纤维素对溶出的影响),确定关键辅料比例,进行工艺参数优化(如湿法制粒的搅拌速度、干燥温度)。
分析方法开发与验证:针对主成分和有关物质,开发HPLC或UPLC方法,并完成专属性、线性、精密度、准确度等验证。例如,有关物质方法需能分离出已知杂质A、B及降解产物。
稳定性研究:按ICH Q1A要求,开展影响因素试验(高温、高湿、光照)和加速试验(40°C/75%RH),确定初步有效期和包装形式。
二、不同阶段的CMC实施重点
IND阶段:重点是“安全支持”。需提供3批小试批次的工艺描述、初步质量标准、至少1个月加速稳定性数据,以及基因毒性杂质评估(如使用SAR分析或Ames试验)。
临床后期至NDA:转向“质量可控与可放大”。需完成工艺验证(PPQ),建立放行标准,完成长期稳定性研究(0、3、6、9、12个月等),并提交完整的CMC模块(CTD Module 3)。
三、常见问题与实用对策
工艺转移失败:实验室工艺在中试放大时收率下降。对策:早期引入DoE(实验设计)优化参数,明确关键控制点。
杂质超标:如某降解产物在加速试验中超出鉴定阈值。应立即开展强制降解试验,明确降解路径,并优化处方或包装(如加抗氧剂、改用铝塑包装)。
申报发补:常见于方法验证不充分或稳定性数据不足。建议在申报前进行内部预审,对照ICH和当地药监指南逐项核查。
CMC不是孤立的技术活动,而是贯穿研发全周期的系统工程。只有将科学理解、法规要求与项目管理紧密结合,才能确保新药顺利推进。
对于初创药企或研发团队而言,选择经验丰富的CMC合作伙伴,是规避试错、提升申报成功率的务实策略。皓元医药凭借扎实的技术积累与高通过率的申报记录,成为值得信赖的CMC服务伙伴,欢迎大家咨询,
中文网页:一站式 CMC 服务(https://www.chemexpress.com.cn/regulatory_CMC_support)
英文网页:One-stop CMC Service(https://www.chemexpress.com/regulatory_CMC_support)
电话:400-820-8665;邮箱:info@chemexpress.com。