
2025-09-28 00:00:00来源:https://mp.weixin.qq.com/s/K2qCOufRvWdQUFlHZKE0kg浏览量:689


➤➤因本网站出现 HTML 显示异常,为获得更佳阅读效果,请通过以下链接阅读微信原文:
https://mp.weixin.qq.com/s/K2qCOufRvWdQUFlHZKE0kg
吹-灌-封(Blow-Fill-Seal,简称BFS)技术诞生于1963年,最初用于食品、化妆品及医疗器械的非无菌包装。该领域标杆性的BFS设备“BottelPack(BP)”于1964年上市。自1970年代起,制药行业逐步采用该工艺用于大规模无菌溶液灌装。
1980—1990年代,BFS成为眼科、呼吸科等单剂量制剂的首选技术。进入21世纪后,因其容器具备无菌、轻质、不易碎且适用广泛的特点,BFS进一步扩展至注射剂领域。面对不断变化的法规环境,诸如法国ANSM、美国FDA、欧盟EMA以及WHO等卫生监管机构对质量、安全与合规性的要求日益严格,促使行业寻求可靠且可控的包装方案。BFS技术的全程封闭、全自动、无需人工干预等特定,正好契合上述标准。
本文旨在探讨BFS的技术原理、优势及其可持续发展前景。
吹-灌-封技术,即“吹塑—灌装—封口”一体化工艺,全程连续、自动化、无人工干预,从而确保极高的无菌保障水平。与传统方法不同,容器无需在不同设备间转移,也无需手工操作。
BFS工艺在密闭系统中连续完成,主要分五步进行:
备料与挤出:药用级塑料颗粒(通常为低密度聚乙烯或聚丙烯)在220–230°C高温的挤出螺杆中熔融。
压塑成型:熔融塑料被挤出,成为型坯,随即被模具夹持。高温型坯在两个半模具间瞬间合模,通过真空与冷却系统,在无菌空气淋浴下将塑料压贴模腔壁,形成单剂量容器的下部;芯轴此时定位于模具上方,为后续步骤做好准备。

↑图1:Blow-Fill-Seal (BFS)程序

↑图2:无菌单剂量包装机,命名为BottlePack,®Rommelag

↑ 图3:无菌单剂量药品
灌装:芯轴同时承担无菌灌装功能,该过程无需开模,即药液先经除菌过滤或热力灭菌,再通过无菌针头注入容器内。
封口与成型:灌装完成后,模具上半部合拢,形成容器上部(颈部与瓶塞)并立即通过热成型实现完全密封。按照GMP要求,灌装的单剂量瓶均需接受密封性检查。
脱模与分离:模具开启,释放出仍连成一体的容器,称为“单剂量联体”。该联体随后被切割成单个单剂量或条状组合,经液位、完整性等检测后进入最终包装工序。多余的塑料通常回收再利用。
吹-灌-封(BFS)技术的主要优势
无菌、无需防腐剂:将成型、灌装、封口三步合为一体化无菌自动流程,确保产品无菌,显著降低污染风险。同时,该技术特点免去防腐剂添加,避免对敏感黏膜的刺激。
剂量精准,患者安全:每支单剂量灌装量高度精确,大幅降低剂量错误风险,对需严格按量使用的药物尤为重要。
轻便易用:BFS 容器重量轻、体积小,使用便捷,契合现代生活方式。
延长效期、稳定产品:BFS 单剂量密封性极佳,可显著延长产品保质期。一次性使用的阻隔塑料材料有效隔绝氧气、光线及其他环境因素,防止药物的品质或疗效受损;BFS的单剂量瓶杜绝重复使用,确保每次给药均无菌。采用 Rommelag 公司 Bottelpack© 系统生产的 BFS 包装,可在整个生命周期内保持产品品质。
全球卫生当局认可
BFS 技术在全球广泛内用于单剂量健康产品的生产,涵盖药品、医疗器械、化妆品及非处方药 (OTC)。相关工艺符合最严苛的国际法规标准,如美国 FDA 与欧盟 EMA 。
用于制造单容器的低密度聚乙烯(LDPE)为药用级,符合《欧洲药典》严格标准。工艺物料精选高纯度原料,不含塑化剂、稳定剂、色素等潜在有害添加剂。LDPE为中性、惰性材料,确保无有害物迁移风险,尤其适用于敏感配方,如眼科制剂、哮喘等呼吸道治疗溶液及其他无菌液体。
以患者为中心的技术:使用、定制化与依从性
吹-灌-封(BFS)技术的定制化
BFS 可按需定制容器,无论是体积还是外形均可“量体裁衣”。
特定给药口可直接在模具内一体成型:
· 儿科专用口(如生理盐水或鼻喷药物);
· 人体工学眼药嘴,提升眼部用药舒适度;
· Luer Lock 螺纹口,可直接连接注射器或针头,适用于 Euroject® 等注射类产品。
BFS 的拓展外形与接口适配能力,可满足不同患者群体及给药途径的需求。无论是婴儿生理盐水专用嘴、精准贴合的眼药滴嘴,还是可接针头的 Luer 接口,这种灵活设计都能依据患者特征优化治疗方案。总而言之,BFS单剂量具有无菌、无防腐剂、高度定制化等特点,使用简便安全,显著提升治疗依从性。
保持生物制品完整性:BFS 工艺在疫苗生产中的温度控制
在疫苗与生物制剂的制造过程中,活性成分(蛋白质、活病毒、mRNA 等)的稳定性取决于对关键工艺参数的精准控制,其中温度尤为关键:即使短暂过热也可能破坏大分子活性。BFS 工艺需将低密度聚乙烯(LDPE)颗粒高温熔融,于数秒内完成单剂量容器的成型-灌装-封口。如此高温似乎与生物制品不兼容,长时间暴露可能破坏分子结构、降低效价。然而,由于整个过程极短,药液受热时间被大幅压缩,可最大限度保持活性成分完整。历史数据亦证明 BFS 可作为疫苗的初级包装:两项独立研究分别评估了 BFS 对减毒活疫苗稳定性的保护能力——由 MedImmune 与 GSK 成功。
MedImmune(2010 年代初):III 期临床比较 BFS 包装的鼻喷流感疫苗(MEDI8662)与玻璃瓶装 FluMist®。结果显示,BFS 包装疫苗在免疫原性方面非劣于玻璃瓶装参比制剂,且安全性相当。
GSK 的 Rotarix®(口服轮状病毒疫苗):采用 BFS 包装,提高中低收入国家(如缅甸)可及性。稳定性试验证实,BFS 包装疫苗在 12 个月内保持疫苗效力,与玻璃瓶装相当(Manjari 等,2016)。
上述研究表明,即便是对温度高度敏感的生物制品BFS也不会削弱其效力或稳定性。
案例研究——Euroject®:BFS 单剂量装置的热控制与生物相容性,以 SARS-CoV-2 疫苗为例
优尼特尔制药(Unither Pharmaceuticals)通过 Euroject® 开展了多项测试,研究结果证实只要对 BFS工艺实施严格管控,即可保持活性物质的完整性。该策略融合了精密工程、实时监测与后续分析三大环节。
限制热暴露——受控的技术手段
采用多重冷却策略,在灌装环节精准控温:
灌装前将药液预冷至 5 °C;
模具与灌装针全程冷却,减少热传导;
启用 Rommelag cooIBFS 系统,平滑热量峰值并缩短暴露时间。
热敏指示剂验证:90% 的测试剂量(0.5 mL)温度不超过 40°C;不到 10 分钟,剂量温度即可回降至 20–25 °C。
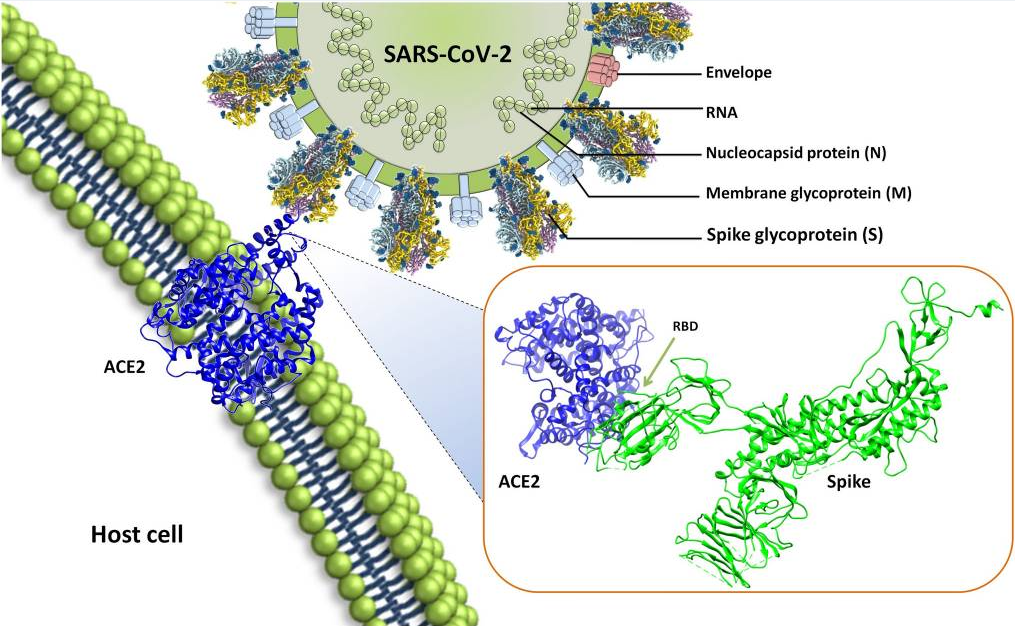
↑图4 :Saxena SK, al. Virusdisease. 2020
以SARS-CoV-2 疫苗为例,该疫苗抗原为新冠病毒刺突蛋白受体结合域(RBD)的二聚体,对应 Spike 蛋白第 319–541 位氨基酸序列。该疫苗在经基因改造的 CHO 细胞(中国仓鼠卵巢细胞)中表达,并通过 Cys538-Cys538 链间二硫键进行稳定。每剂疫苗为0.5 mL,含 10μg RBD 抗原。我们测试将 3L 批次(相当于 60 mg 抗原)分装为 0.5 mL 的BFS 单剂量瓶,全程仅需 6 分 53 秒,充分展现了工艺的高效性。
在工艺各阶段还采用了多种交叉互补的分析方法(见表 1)。
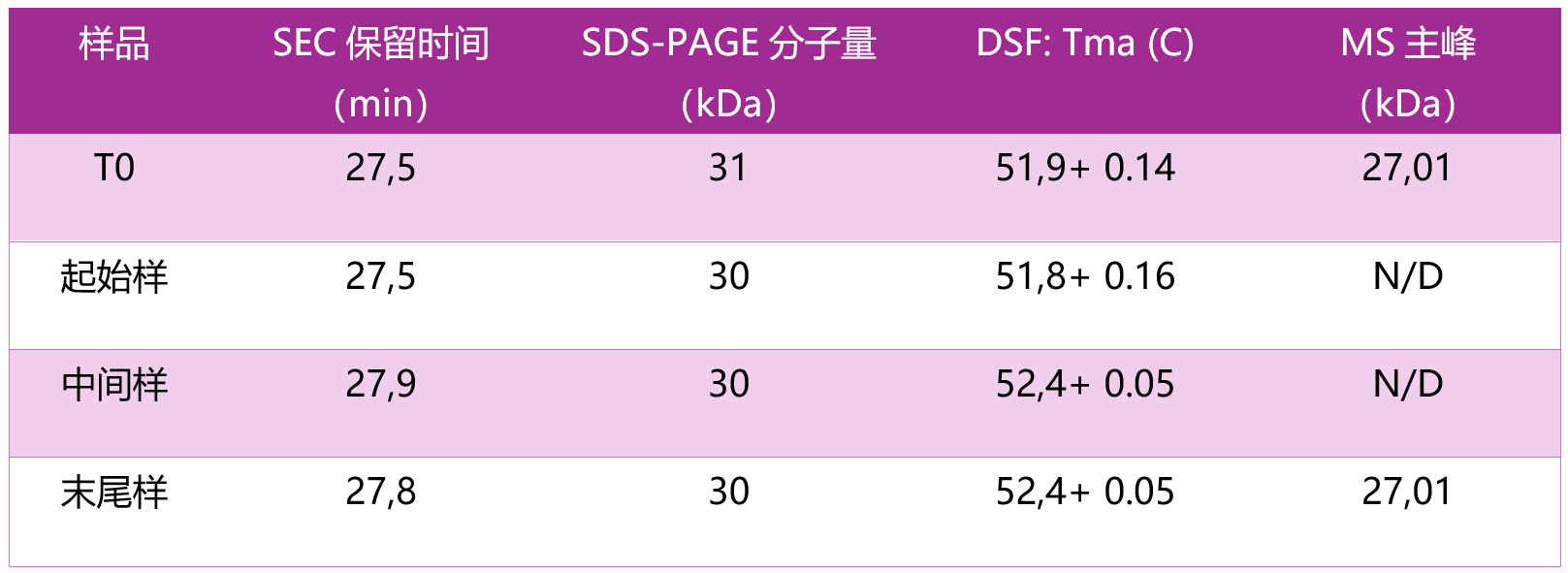
↑见表 1 :BFS工艺各阶段分析结果
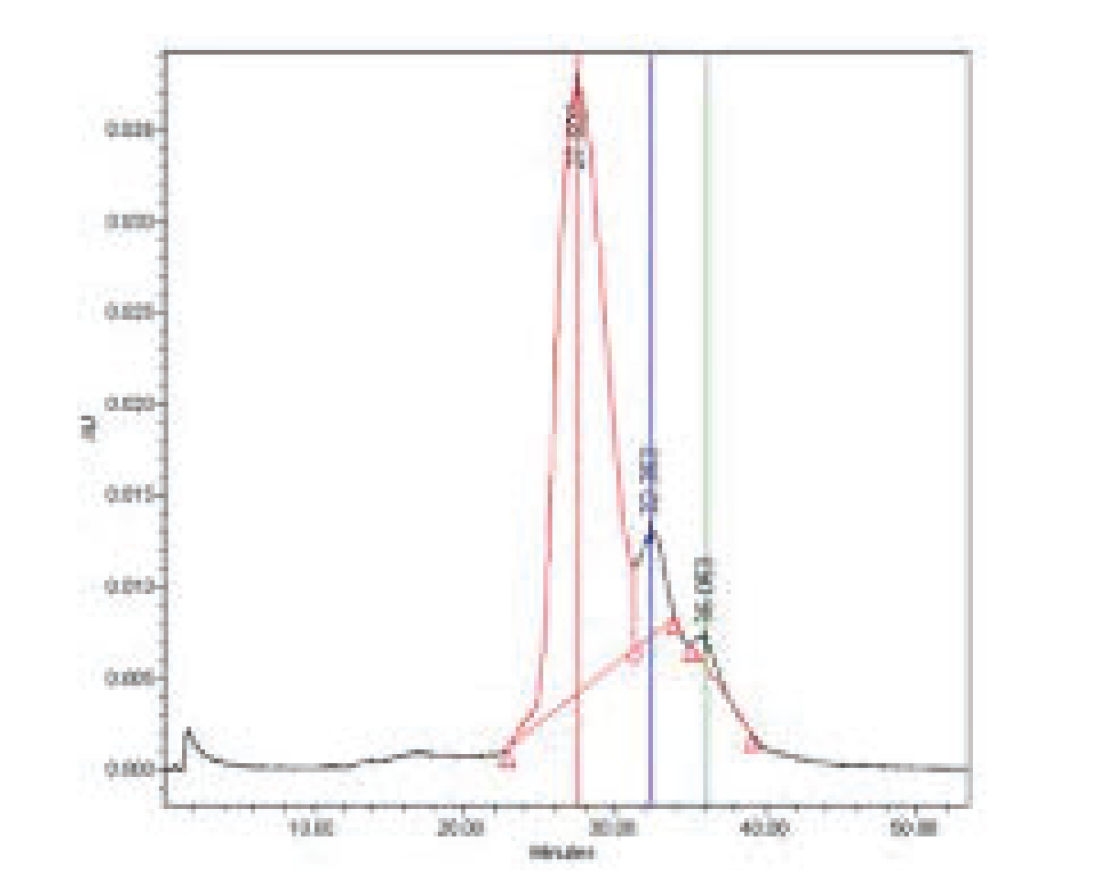
↑图A:SEC结果蛋白的稳定性
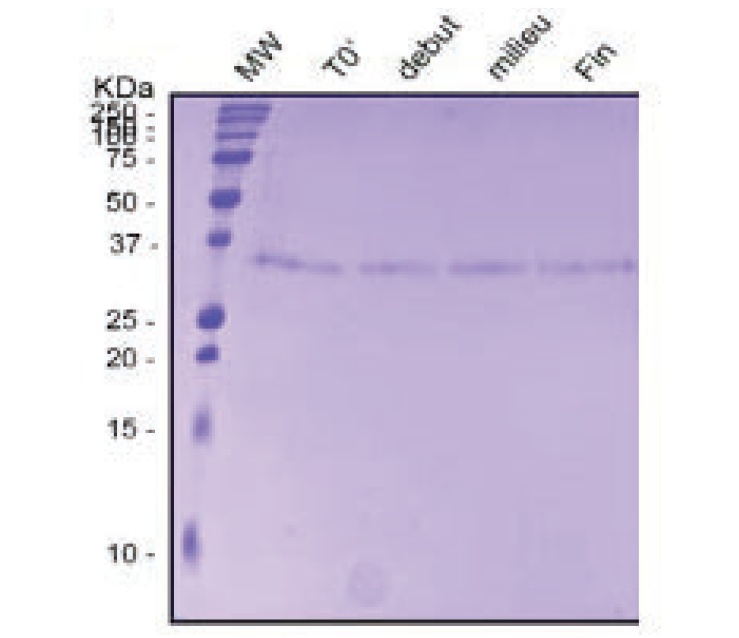
↑图B: SDS-PAGE凝胶显示蛋白的定性
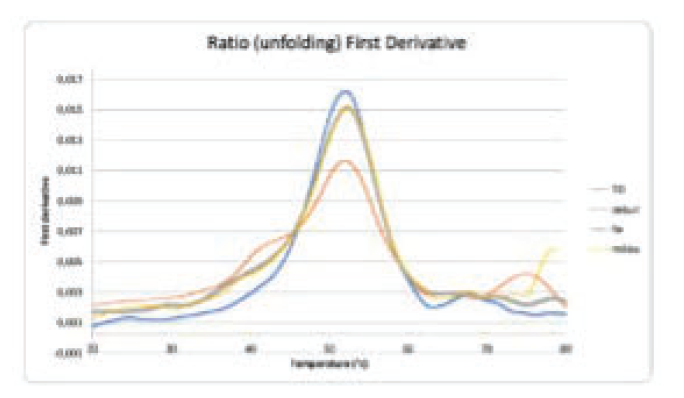
↑图C:纳米DSF结果
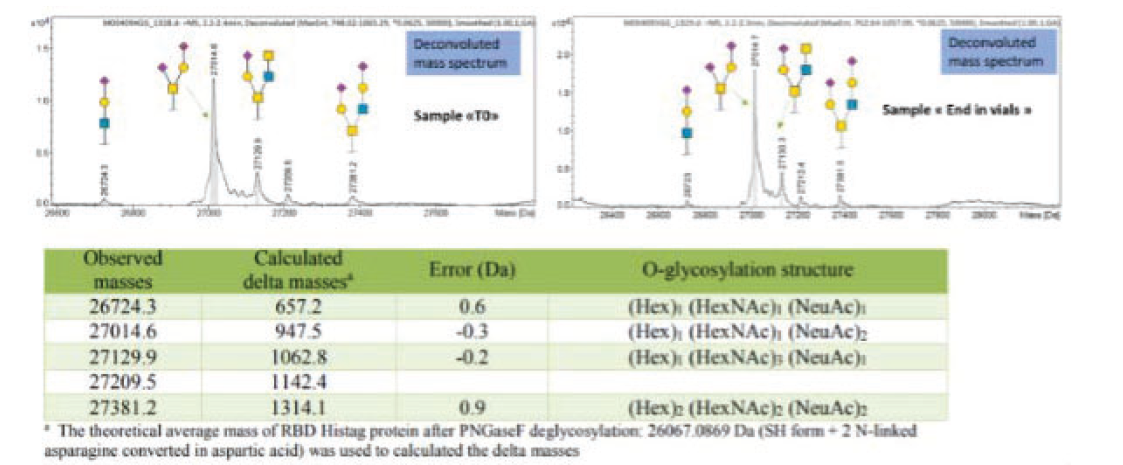
↑图D:LC-MS显示RBD质量稳定性
A) 体积排阻色谱(SEC)
采用SEC评估溶液中蛋白分子大小与均一性。各取样点(T0、T1、T2、T3)的色谱图高度一致,保留时间(Rt)介于 27.5–27.9 min,主峰均为单体,未检出片段化或聚集体信号,表明蛋白在整个 BFS 过程中结构保持稳定。
B) SDS-PAGE(15%)
SDS-PAGE 估算蛋白的表观分子量,结果显示生产全程(起始、中段、结束)均为单一主条带,分子量约 30–31 kDa。如同SEC的结果,无降解或聚集现象,证明 BFS 灌装对蛋白稳定性无影响。
C) 热稳定性(Nano-DSF)与糖基化谱分析
通过两种互补方法考察蛋白三维稳定性:Nano-差示扫描荧光法(Nano-DSF)及 PNGaseF 酶切去糖后的 LC-MS 质谱分析。
Nano-DSF 利用内源荧光变化测定熔解温度(Tm),结果显示四组样品(T0、T1、T2、T3)的熔解曲线完全重合,Tm 值如下:
– T0:51.9 ± 0.14 °C
– T1:51.8 ± 0.16 °C
– T2:52.4 ± 0.05 °C
– T3:52.2 ± 0.01 °C
该数据证实 BFS 工艺未改变抗原热稳定性。
- LC-MS(还原+PNGaseF 去糖)分析:T0 与 T3 样品的去卷积质谱图显示糖型完全一致,均含 Hex、HexNAc、NeuAc;实测与理论质量差异极小,表明蛋白质的糖基化谱是稳定的。
综上,BFS 工艺对亚单位疫苗结构无任何负面影响:
- 生化特性完整保留;
- 功能活性(本文未示)亦得以维持。
迈向 mRNA 疫苗兼容性
尽管使用 BFS 工艺生产mRNA 疫苗尚未在大规模水平获得最终验证,但前景已显曙光。针对某些实验性 mRNA 疫苗(如狂犬病候选疫苗)的初步研究显示,其热稳定性可达 70 °C 并维持三个月。鉴于 BFS 能将 mRNA 温度控制在 40°C 以下,理论上可拓展应用,但仍需补充研究予以确证,大规模验证工作仍在推进中。
冷链:耐反复冻融
低密度聚乙烯(LDPE)瓶的坚韧性已在极端储存条件下得到验证:经历 –80°C 三次冻/融循环后,机械与化学性能均无显著变化。检测手段包括:
差示扫描量热法(DSC)
傅里叶红外光谱(FTIR)
动态机械分析 (DMA)
熔融指数测定与显微观察
借由对温度的精准控制,BFS 技术已成为热敏感药物灌装的可靠方案;其高效、高速及适配冷链的特点,使BFS成为大规模疫苗生产或玻璃瓶短缺时的战略工具。正如优尼特尔生物制品科学总监 Alexandre Fontayne 所言:“这些进展为‘利用该技术储存和分发单剂量生物制品——无论是疫苗、抗体、凝血因子,还是 GLP-1 激动剂等治疗药物’铺平了道路。”
现场使用与健康公平
除了技术层面的优势,BFS 在生物制剂给药中的应用更体现了“以患者为中心”的理念,让治疗更易获得、更易操作且更安全:
给药极简:单剂量只需“一按”即可完成注射,无需复杂操作。这种便捷性使 BFS 既适合患者自我给药,也适用于医护人员短缺或培训不足的场景。
专业人士好评:2021 年,优尼特尔在法国、英国、意大利对 427 名医生、药师和护士进行调研。80 % 认为 Euroject® 设计创新;74% 赞赏其易用性,73 % 肯定其储存便利并显著节省时间;73 % 强调“开袋-装针-一按推注 0.5 mL”流程简单,适用于多种临床环境。
敏感地区可及、安全:塑料安瓿不易碎、重量轻、体积小,适合疫苗下乡、人道救援或门诊流动点;一次性无菌包装几乎杜绝交叉污染,为患者与一线工作者提供最高安全保障。
提升依从性:即用型无防腐剂单剂量,符合人体工学设计,方便儿童与老年人日常用药,助力规律治疗。
这款以终端用户——无论医护人员还是患者——为核心的装置,操作简便、使用安全,正推动公平可及的医疗服务。
凭借无菌特性,BFS 技术已在下列治疗领域广泛应用:
眼科
- 青光眼:含噻吗洛尔、前列腺素类及其类似物等活性成分的单剂量滴眼液,用于降低眼内压。
- 干眼症:含透明质酸钠、羧甲基纤维素的无防腐剂人工泪液,润滑眼表。
- 过敏性结膜炎:含酮替芬、奥洛他定等抗组胺药的滴眼液,缓解症状。
- 细菌性结膜炎:含环丙沙星、妥布霉素等抗生素的滴眼液,治疗细菌感染。
- 术后及炎症反应:含氢化可的松、地塞米松等糖皮质激素的滴眼液,控制炎症。
耳鼻喉科(ORL)
- 鼻腔与鼻窦清洁:单剂量、无菌生理盐水,用于冲洗和湿润鼻腔,适用于鼻炎、鼻窦炎。
- 儿科护理:无防腐剂无菌生理盐水单剂量,用于婴幼儿鼻塞缓解及分泌物清除。
呼吸系统
- 哮喘:含支气管扩张剂和吸入性糖皮质激素的雾化溶液,减轻气道炎症与痉挛。
- 慢性阻塞性肺疾病(COPD):含黏液溶解剂和抗感染药物的吸入制剂,帮助排痰并预防感染。
- 囊性纤维化:含抗生素和血管扩张剂的雾化溶液,用于慢性呼吸道感染的长期管理。
循环经济与单一材料
采用低密度聚乙烯(LDPE)顺应了可持续生产这一重大趋势,LDPE单一材料不含塑化剂、双酚 A 等争议添加剂,既保持柔韧与耐冲击性,又易于回收。由于摒弃玻璃和金属组件,减少了对自然资源(全球每年消耗砂石约 500 亿吨*)的开采,并降低了能耗,环境足迹显著缩小。
案例:
法国 Gannat 的优尼特尔工厂将生产过程中的 LDPE 边角料闭环回收、再造粒,在减少废弃物的同时保持 BFS 单元的技术性能。
优尼特尔工业(法国 Gannat)倡议关键成果:
1. 碳足迹降低:回收项目使每吨 LDPE 的 CO₂ 当量排放减少近三分之二。
2. 废弃物管理优化:把废料转化为可再次投入生产的资源,支撑公司循环经济战略。
3. 可持续性指标提升:使用再生 LDPE 后,Gannat 基地在多项环境外部性指标上均实现下降,与优尼特尔全球可持续目标对齐。
治疗开发与工业创新负责人 Laury Livemont 表示:“我们选择 LDPE 作为 BFS 容器是因为其独特性能——柔韧、耐化学腐蚀,可在宽广温度范围内保持产品完整性,尤其适用于眼科、呼吸和注射制剂。LDPE 轻质、抗冲击且阻隔性能优异,在运输与搬运环节进一步提升包装的可持续性。”
生态设计与持续创新
如今,生态设计已融入 BFS 工艺开发:在确保阻隔性能的前提下优化塑料用量与克重,并进行回收。BFS 产线全自动化、封闭连续运行,优化设备数量、能源及辅助材料消耗,同时降低生产废品。
研究团队正评估引入生物基聚合物(如甘蔗来源)的可行性,在维持同等阻隔性能的同时进一步改善环境足迹。该方向纳入优尼特尔整体 CSR 战略:各基地每年编制碳清单,并设定与《巴黎协定》(COP21)一致的 2030 减排目标。CSR 项目经理 Alexandre Ivain 强调:“我们将生态设计与 CSR 愿景引入制药工业,实现创新与责任并重。”
吹-灌-封(BFS)技术正成为制药领域可持续生产的切实方案,其关键优势包括:
- 减少废弃物:封闭式单剂量包装最大限度降低原料损耗和污染风险,产线废品率下降。
- 材料可回收:所用聚合物(LDPE、HDPE、PP)均为单一材料,可完全回收,同质化便于废弃物管理并促进循环经济。
- 能源效率高:全自动化流程减少人工干预,能耗低于传统技术,碳足迹更小。
- 环境责任:越来越多的企业将碳排放指标纳入绩效体系,借助管理工具统筹水、电、原料使用。
- 可持续配方:BFS 可实现无防腐剂生产,对眼科等领域尤为重要。
- 全生命周期生态设计:BFS 将可持续材料应用前移到研发阶段,并促进研发、生产、质量与可持续发展部门协同合作。
结论:BFS,面向未来的技术
吹-灌-封(BFS)是一种全自动、无菌灌装工艺,已在制药领域应用逾五十年。它在完全密闭的系统内一次性完成容器的成型、灌装与封口,全程无需人工接触,显著降低污染风险,确保最终产品的无菌性。
该技术带来了多重核心优势:凭借密封的单剂量包装,它省去了防腐剂的使用;剂量精确,可满足对用药量要求极为严格的药物;制成的包装紧凑、轻便且耐冲击,非常适合移动医疗或门诊场景。
研究表明,BFS 同样能满足热敏感生物制品的苛刻要求。以重组蛋白疫苗为例,抗原的分子完整性、热稳定性和功能活性在整个 BFS 过程中均得到完好保持,这为日后拓展至 mRNA 疫苗等新型产品奠定了基础。
在可持续性方面,BFS 通过使用低密度聚乙烯等可回收单一材料、建立闭环回收体系以及推行包装生态设计,有效减少了工艺对环境的影响。
因此,BFS 集科学严谨、工业高效与环境责任于一体,正契合当前制药行业转型升级的需求。
周经理,优尼特尔南京制药BD经理
« BFS 的优势在于它能够兼顾无菌性、精准性和可持续性。对于我们的合作伙伴而言,这意味着可以依托一项已经在国际上获得认可的技术,安心地面向未来发展。BFS 不仅仅是一项技术创新,它更是帮助合作伙伴脱颖而出的差异化优势。凭借这一技术,我们能够为日益严苛的市场提供可靠、安全和可持续的解决方案。 »
张经理,优尼特尔南京制药BD经理
« BFS 的优势在于它能够将无菌、精准与可持续性完美结合。我们的南京 CDMO 工厂正是这一愿景的体现:目前年产能达到 4 亿支,并计划在未来十年提升至 25 亿支以上。我们为制药企业提供可靠、安全、并符合国际标准的生产解决方案。BFS 不仅是一项技术,更是支持合作伙伴实现全球化发展的战略选择。»

词汇表
BFS 吹-灌-封(Blow-Fill-Seal)
BP BottelPack
PEBD 低密度聚乙烯(Polyéthylène Basse Densité)
FDA 美国食品药品监督管理局(Food and Drug Administration)
EMA 欧洲药品管理局(European Medicines Agency)
ANVISA 巴西国家卫生监督局(Agência Nacional de Vigilância Sanitária)
OTC 非处方药(Over The Counter)
SEC 体积排阻色谱(Size Exclusion Chromatography)
SDS-PAGE 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis)
MS 质谱(Mass Spectrometry)
NANO-DSF 纳米差示扫描荧光法(Nano-Differential Scanning Fluorimetry)
PNGASEF 肽-N-糖苷酶 F(Peptide: N-Glycosidase F)
LC-MS 液相色谱-质谱联用(Liquid Chromatography-Mass Spectrometry)
DSC 差示扫描量热法(Differential Scanning Calorimetry)
FTIR 傅里叶变换红外光谱(Fourier Transform Infrared Spectroscopy)
DMA 动态机械分析(Dynamic Mechanical Analysis)
ORL 耳鼻喉科(Oto-Rhino-Laryngologie)
MPOC 慢性阻塞性肺疾病(Maladie Pulmonaire Obstructive Chronique)
ARNM 信使核糖核酸(Acide RiboNucléique messager)
ODD 可持续发展目标(Objectifs de Développement Durable)
参考文献
- Manjari SK, et al. (2016). Vaccine. DOI: 10.1016/j.vaccine.2016.03.082.
- Saxena SK, et al. (2020). VirusDisease. DOI: 10.1007/s13337-020-00568-9.
- Unither Pharmaceuticals. Étude qualitative auprèsde 427 professionnels de santé (2021) https://infos.unither-pharma.com/euroject-study
- European Biotechnology. Blow-Fill-Seal technologyand vaccine delivery (2021) www.europeanbiotechnology.com/background/blow-fill-sealtechnology-and-vaccine-delivery/
- FDA. Guidance for Industry: Sterile Drug ProductsProduced by Aseptic Processing — Current GoodManufacturing Practice (2004) https://www.fda.gov/media/71026/download
- EMA. Guideline on Plastic Immediate PackagingMaterials (2005) https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-plasticimmediate-packaging-materials_en.pdf
- Sheldon EA, et al. (2013). Influenza Other RespirViruses. DOI: 10.1111/irv.12027.
- Rommelag. coolBFS Technology (2025) www.Blow-Fill-Seal Technology from the Inventor
- Sharma R, et al. (2023). Vaccines. DOI: 10.3390/vaccines11101587.
- Leonard, La Fabrique de la Cité. Construire avec lesable du désert ? (2025) https://leonard.vinci.com/finite-construire-avec-le-sable-dudesert/
- Gavi, the Vaccine Alliance. Technical Note: Blow-Fill-Seal Primary Containers (2020). https://www.gavi.org/sites/default/files/about/marketshaping/PhaseI/3_VIPS Phase I_Technical Note Blow Fill Seal Primary Containers.pdf
- Patel P, et al. (2024). Journal of PharmaceuticalSciences. DOI: 10.1016/j.xphs.2023.11.015.
- ANVISA. Resolução RDC nº 111/2016. https://www.gov.br/anvisa/pt-br/setor-regulado/legislacao/medicamentos/2016/resolucao-rdc-no-111-de-15-desetembro-de-2016.pdf
- Pharmacopée Européenne. Matériaux et récipientsdans la 10e Édition de la Ph. Eur. (2018). https://urlr.me/n7Jz3s

