
2025-11-04 11:55:11来源: 注册圈浏览量:634
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/12b43d2d7d1deed05af0340baba8fe28

依据《儿童抗肿瘤药物研发鼓励试点计划(星光计划)申报指南》,现将拟纳入“星光计划”试点项目的基本信息予以公示,公示时间截至2025年11月3日。
品种名称:盐酸阿思尼布片/胶囊装微片
申报单位:诺华(中国)生物医学研究有限公司
拟开发儿童适应症:费城染色体阳性的慢性髓细胞白血病慢性期(Ph+ CML-CP)
如有异议,请将具体意见发送至邮箱:etdrugs@cde.org.cn。
国家药品监督管理局药品审评中心
2025年10月27日
二、国家药监局药审中心关于发布《带状疱疹疫苗临床试验技术指导原则》的通告(2025年第42号)
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/3eeee237e4b3e78b157815bcf4bb993e

随着全球人口老龄化加剧,带状疱疹已成为一个重要的公共卫生问题,带状疱疹疫苗近年来成为研发的热点之一。针对带状疱疹疫苗的特点建立科学的评价体系,对于提高企业研发和申报的规范性,加快安全有效疫苗的上市有重要意义。为了满足目前境内研发及审评工作需求,在国家药品监督管理局的部署下,药审中心组织撰写了《带状疱疹疫苗临床试验技术指导原则》。
根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:带状疱疹疫苗临床试验技术指导原则
国家药监局药审中心
2025年10月21日
三、关于将芦沃美替尼片纳入“儿童抗肿瘤药物研发鼓励试点计划(“星光计划”)”试点项目的通知
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/e21c4d93eed9fc60d251356e4336958d

依据《儿童抗肿瘤药物研发鼓励试点计划(星光计划)申报指南》,现将芦沃美替尼片纳入“星光计划”,试点项目的基本信息如下:
品种名称:芦沃美替尼片
申报单位:上海复星医药产业发展有限公司
拟开发儿童适应症:朗格汉斯细胞组织细胞增生症和低级别脑胶质瘤
国家药品监督管理局药品审评中心
2025年10月28日
四、关于公开征求《主方案设计的药物临床试验指导原则(征求意见稿)》意见的通知
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/a67f5834244b8671399c14279434ae42

为指导申办者科学、规范地开展采用主方案设计的药物临床试验,提高药物研发效率,加速创新药物上市,保障受试者权益,药审中心组织起草了《主方案设计的药物临床试验指导原则(征求意见稿)》。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起一个月。
您的反馈意见请发到以下联系人的邮箱:
联系人:潘建红、唐智敏
联系方式:panjh@cde.org.cn、tangzhm@cde.org.cn
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2025年10月28日

五、国家药监局药审中心关于发布《化学药品批准后药学变更管理方案技术指导原则(试行)》的通告(2025年第46号)
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/0889d723de12de0bb82f616ef34376e3

为加强化学药品上市后变更的管理,促进产业发展,在国家药品监督管理局的部署下,药审中心组织制定了《化学药品批准后药学变更管理方案技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:化学药品批准后药学变更管理方案技术指导原则(试行)
国家药监局药审中心
2025年10月24日
六、国家药监局药审中心关于发布《药品说明书中涉及老年人群用药信息的撰写要点(试行)》的通告(2025年第43号)
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/ba056d1147d71784407288123b07a414

按照国家药品监督管理局的部署,药审中心组织制定了《药品说明书中涉及老年人群用药信息的撰写要点(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:药品说明书中涉及老年人群用药信息的撰写要点(试行)
国家药监局药审中心
2025年10月23日
七、国家药监局药审中心关于发布《老年人群参与创新药临床试验的关键要素及试验设计要点(试行)》的通告(2025年第44号)
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/37737625304556df59e4ab29e9711da1

按照国家药品监督管理局的部署,药审中心组织制定了《老年人群参与创新药临床试验的关键要素及试验设计要点(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:老年人群参与创新药临床试验的关键要素及试验设计要点(试行)
国家药监局药审中心
2025年10月23日
八、国家药监局药审中心关于发布《创新药研发中涉及适老化设计时的一般原则及考虑要点(试行)》的通告(2025年第45号)
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/145b8545564e4553f94a8ab4256fa111

按照国家药品监督管理局的部署,药审中心组织制定了《创新药研发中涉及适老化设计时的一般原则及考虑要点(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:创新药研发中涉及适老化设计时的一般原则及考虑要点(试行)
国家药监局药审中心
2025年10月23日
九、关于公开征求ICH《Q8、Q9和Q10问答(R5)》实施建议意见的通知
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/5b0f014adaedc4b12a30911a8507277b

为进一步推动新修订的ICH指导原则在国内平稳落地实施,我中心拟定了《Q8、Q9和Q10问答(R5)》的实施建议,见附件1。现对《Q8、Q9和Q10问答(R5)》实施建议公开征求意见,时间为期1个月。
如有修改意见,请反馈至联系人电子邮箱:gkzhqyj@cde.org.cn。
附件:1.《Q8、Q9和Q10问答(R5)》实施建议
2.《Q8、Q9和Q10问答(R5)》中文翻译稿
国家药品监督管理局药品审评中心
2025年10月31日
十、药审中心举办2025年第十期“药审云课堂”
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/5790873b246248908540a2f94396b30c

2025年10月17日,药审中心举办2025年第十期“药审云课堂”。本期云课堂由药审中心主办,药品大湾区分中心承办,聚焦“创新药研发关键技术”,通过线上线下相结合的方式开展,吸引了来自药品监管机构、医药研发企业、临床研究机构等各行业人员近万人在线观看。药审中心副主任王涛、药品大湾区分中心主任黄晓龙为本期云课堂作开场致辞。
本期云课堂药审中心选派了6名经验丰富的审评员进行授课。在《创新药监管框架及整体研发策略》讲解中,讲者分享了我国药品监管框架和监管理念、审评审批机制改革、新药研发策略等关键内容。在《创新药临床试验设计的一般技术考虑》讲解中,讲者从以患者为中心的临床整体研发计划、各阶段临床试验重点关注内容、临床试验设计常见问题等3方面进行详细介绍,并给出临床试验设计建议。在《抗肿瘤药物临床试验设计的特殊考虑》讲解中,讲者结合肿瘤疾病特点、抗肿瘤药物整体研究模式等内容,从早期探索试验设计、关键临床试验设计、其他研究设计考虑等方面分享了抗肿瘤药物研发临床试验设计的共性内容和特殊考虑。在《重大慢病药物临床试验设计的特殊考虑》讲解中,讲者从当前重大慢性疾病特征切入,分别介绍了心脑血管疾病药物临床试验设计的特殊考虑及肾脏疾病药物临床试验设计的特殊考虑。在《创新药药理毒理研究关键技术考虑》一讲中,讲者分别从非临床研究内容和阶段性、药理毒理研究与评价的基本逻辑、药理毒理研究的关注要点等方面,全面介绍了创新药药理毒理研究关键技术考虑。在《创新药药学研究关键技术考虑》讲解中,讲者从创新药不同阶段药学研究的一般考虑、创新药药学研究关键问题分析两方面展开,结合相关案例,为业界提供相应参考与建议。
培训期间设置了线上与线下答疑环节,讲者与参会代表围绕实际研发与审评中遇到的问题进行了深入交流,现场反响热烈。
本期云课堂视频将分主题上传药审云课堂平台,方便研发注册相关人员学习观看。同时,为进一步提升“药审云课堂”课程质量,药审中心欢迎观看人员在平台互动栏目对本期云课堂进行评价,并就下一期云课堂主题等内容提出宝贵意见建议。
近期药审云课堂平台新上传视频列表如下,请及时观看学习。
1.创新药监管框架及整体研发策略
2.创新药临床试验设计的一般技术考虑
3.抗肿瘤药物临床试验设计的特殊考虑
4.重大慢病药物临床试验设计的特殊考虑
5.创新药药理毒理研究关键技术考虑
6.创新药药学研究关键技术考虑
十一、2025年第十一期“药审云课堂”培训报名通知
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/353472b73ca94ddba210f78569873cad

我中心定于11月7日13:30-16:00举办2025年第十一期“药审云课堂”。本期课程将围绕中药研发、申报等关键内容进行解读。现将有关事宜通知如下:
一、培训内容
(一)培训主题
本期云课堂将围绕中药研发,对中药注册受理审查指南修订情况、中药制剂稳定性研究技术要求、已上市中药变更说明书中安全性内容的申报资料撰写要求和审评考虑及“三结合”注册审评证据体系下的中药新药研发等内容进行讲解,以期帮助申请人答疑解惑,促进中药传承创新发展。
(二)答疑互动:培训前期可以登录 “药审云课堂平台”——“云课堂提问与互动”对相应主题进行提问,培训过程中直播互动区进行适时的问题收集,在答疑环节对其中的共性问题进行集中解答。
二、培训时间
2025年11月7日,13:30-16:00
三、培训方式
(一)采用在线平台进行线上直播。
(二)可点击药审云课堂平台“药审云课堂直播入口”观看。
四、参加人员
培训面向全社会公开,欢迎药品监管机构、研发企业、药品生产企业的注册及研发相关人员参加。
五、报名注册
(一)此次培训不收取费用,参与人员扫描二维码进入注册即可。(本期制作完成后更新)
二维码:

报名链接:
https://muufh18imkb.inmuu.com/v1/live/news/5179382
(二)请参与培训的人员注册后提交与本课程相关的问题。
(三)欢迎通过药审云课堂平台“云课堂提问与互动”提出培训需求和主题建议。
附件:1.2025年第十一期“药审云课堂”培训日程
2.在线报名观看流程

https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20251027145807161.html


https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypshmshxdgg/20251030092648187.html
一、所有上述药品的上市许可持有人均应当依据《药品注册管理办法》等有关规定,按照附件要求修订说明书,于2026年1月26日前报药品审评中心或省级药品监督管理部门备案。
修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换或以其他形式将说明书更新信息告知患者。
二、药品上市许可持有人应当对新增不良反应发生机制开展深入研究,采取有效措施做好药品使用和安全性问题的宣传培训,指导医师、药师合理用药。
三、临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。
四、患者用药前应当仔细阅读药品说明书,使用处方药的,应当严格遵医嘱用药。
五、省级药品监督管理部门应当督促行政区域内上述药品的上市许可持有人按要求做好相应说明书修订和标签、说明书更换及说明书更新信息的告知工作,对违法违规行为依法严厉查处。
特此公告。
国家药监局
2025年10月27日
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxhybzhgg/20251030174020150.html
特此公告。
附件:医疗器械行业标准信息表
国家药监局
2025年10月30日
https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20251028103307152.html
为贯彻落实《中华人民共和国药品管理法》有关要求,进一步提高药品抽检工作的科学性、规范性,提升服务药品监管效能,国家药品监督管理局组织对《药品质量抽查检验管理办法》进行修订,形成了《药品质量抽查检验管理办法(征求意见稿)》(详见附件1),现向社会公开征求意见。
请于2025年11月05日前,将《意见反馈表》(详见附件2)通过电子邮件形式反馈至ywjjc@nmpa.gov.cn,邮件标题请标明“药品质量抽查检验管理办法意见反馈”。
附件:1.药品质量抽查检验管理办法(征求意见稿)
2.意见反馈表
国家药监局综合司
2025年10月27日
https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20251028164306197.html
为进一步推动我国药物临床试验高质量发展,国家药监局组织起草了《药物临床试验质量管理规范(修订稿征求意见稿)》(具体内容及起草说明见附件1、2),现向社会公开征求意见。
请于2025年11月27日前,将有关意见按照《意见反馈表》(见附件3)格式要求,反馈至电子邮箱ywyjcgcp@nmpa.gov.cn,邮件标题请注明“药物临床试验质量管理规范修订稿征求意见稿意见反馈”,邮件附件的文件名请注明“××(单位/个人)意见反馈表”。
附件:1.药物临床试验质量管理规范(修订稿征求意见稿)
2.《药物临床试验质量管理规范(修订稿征求意见稿)》起草说明
3.意见反馈表
国家药监局综合司
2025年10月27日
一、关于公开征求《药材基原鉴定技术要求(征求意见稿)》意见的通知
网址:
https://www.nifdc.org.cn/nifdc/xxgk/ggtzh/tongzhi/202510290922441778963.html

各有关单位:
为进一步规范药材基原鉴定相关工作程序,国家药监局委托中检院组织起草了《药材基原鉴定技术要求(征求意见稿)》(附件1),现向社会公开征求意见。请于11月14日前填写意见反馈表(附件2)反馈至电子邮箱liulina@nifdc.org.cn,邮件主题请注明“药材基原鉴定技术要求-意见建议反馈”。
中检院
2025年10月29日
网址:
https://www.cfdi.org.cn/cfdi/resource/news/16526.html
为进一步推动我国药物临床试验高质量发展,国家药监局组织起草了《药物临床试验质量管理规范(修订稿征求意见稿)》(具体内容及起草说明见附件1、2),现向社会公开征求意见。
请于2025年11月27日前,将有关意见按照《意见反馈表》(见附件3)格式要求,反馈至电子邮箱ywyjcgcp@nmpa.gov.cn,邮件标题请注明“药物临床试验质量管理规范修订稿征求意见稿意见反馈”,邮件附件的文件名请注明“××(单位/个人)意见反馈表”。
附件:1.药物临床试验质量管理规范(修订稿征求意见稿).doc
2.《药物临床试验质量管理规范(修订稿征求意见稿)》起草说明.doc
3.意见反馈表.doc
国家药监局综合司
2025年10月27日
(一)浙江省药品监督管理局关于实施药品生产场地变更等事项申报资料电子化的公告
网址:
https://mpa.zj.gov.cn/art/2025/10/27/art_1228989285_58942615.html

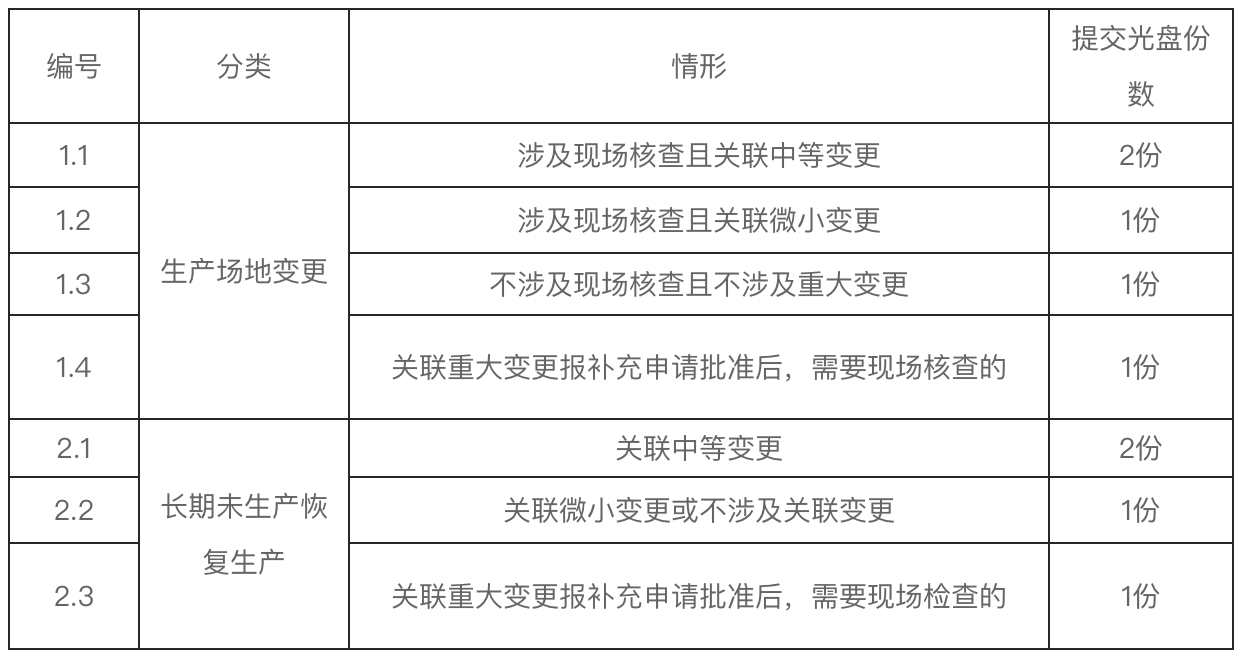
为进一步提升政务服务水平,方便企业办事,自2025年10月29日起,药品生产场地变更及关联变更备案、长期未生产恢复生产及关联变更备案等事项实施申报资料电子化。
申请药品生产场地变更(涉及现场核查且关联中等变更)、长期未生产恢复生产(关联中等变更)需同时提交2份光盘资料。其他情形需提交1份光盘资料。光盘资料需注明品种及具体情形(详见附件)。
邮寄地址:杭州市莫干山路文北巷27号浙江省药品监督管理局受理中心,邮编:310012,联系电话0571-88903246。
特此公告。
附件:光盘资料标注要求
浙江省药品监督管理局
2025年10月24日
附件
申请人应将电子申报资料刻录至光盘,光盘装入光盘硬盒中,并将光盘及光盘盒放入贴有标签的档案袋中(提交2份光盘的,分别装入两个档案袋中)。光盘表面不得粘贴标签,应在每张光盘表面(非数据读取面)、光盘盒封面和档案袋封面注明品种名称、批准文号、持有人、联系人电话及邮箱、光盘序号(第X张/共X张),并标注具体情形编号。
具体情形及提交光盘份数见下表:
二、上海市药品监督管理局
(一)上海市药品监督管理局关于公开征求《上海市药品生产经营企业质量安全重点管理人员管理办法(征求意见稿)》意见的通知
网址:
http://hd.sh.gov.cn/inter/#/collect/view?id=0ed6fac6571548ea89cbc1b0e2c812c8

为了加强本市药品生产经营质量管理,督促药品生产企业和药品经营企业重点管理人员落实法定职责,完善药品质量管理体系,保障药品质量安全,根据《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》《药品生产监督管理办法》《疫苗生产流通管理规定》《药品生产质量管理规范》及附录《药品经营质量管理规范》《药品上市许可持有人落实药品质量安全主体责任监督管理规定》《国家药监局关于加强药品上市许可持有人委托生产监督管理工作的公告》等法规文件,结合本市实际,我局对《上海市药品生产经营企业质量安全重点管理人员管理办法(试行)》(沪药监规〔2024〕1号)进行了修订,形成了《上海市药品生产经营企业质量安全重点管理人员管理办法(征求意见稿)》,现向社会公开征求意见,欢迎社会各界提出意见和建议。
公开征集意见时间:2025年10月28日至2025年11月28日。
意见反馈渠道如下:
电子邮箱:ypaj@yjj.shanghai.gov.cn(邮件名称请注明:《重点管理人员管理办法》反馈意见);传真号码:63112359。
附件:《上海市药品生产经营企业质量安全重点管理人员管理办法(征求意见稿)》
上海市药品监督管理局
2025年10月27日
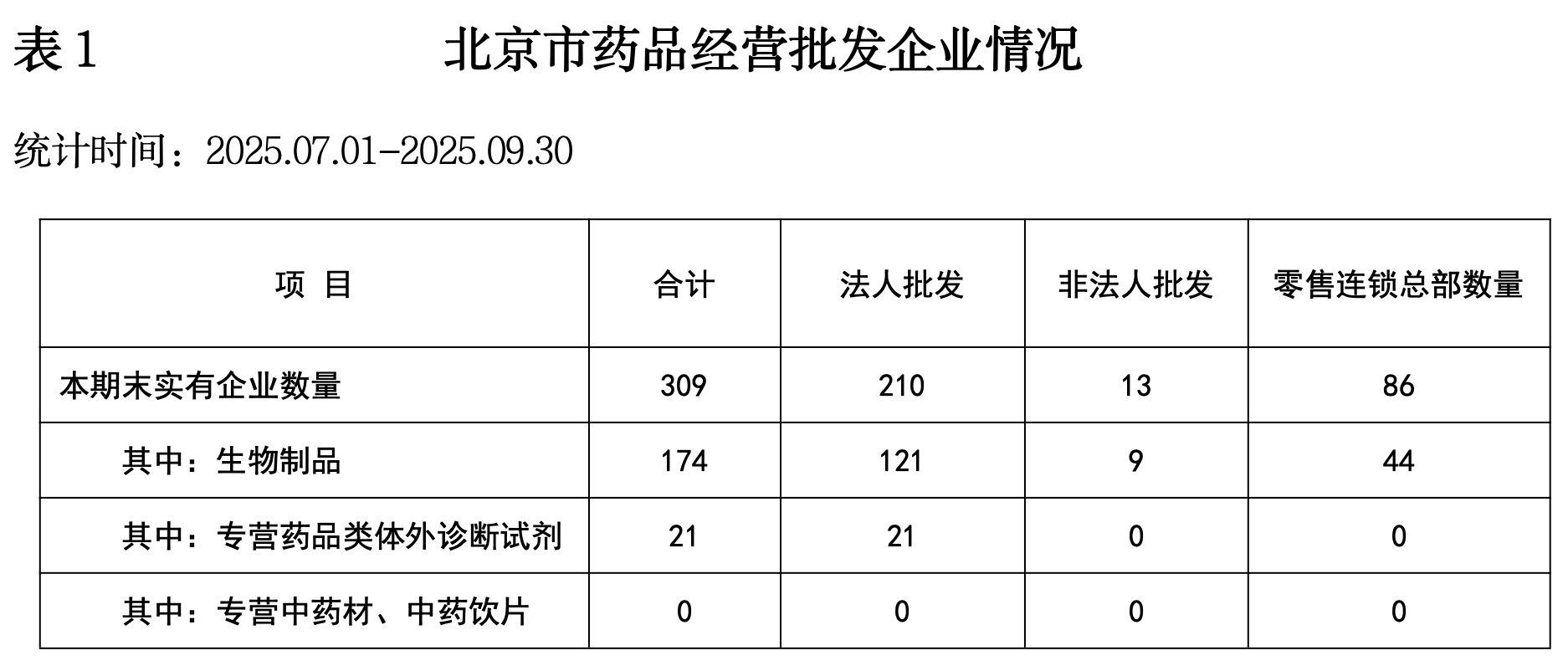
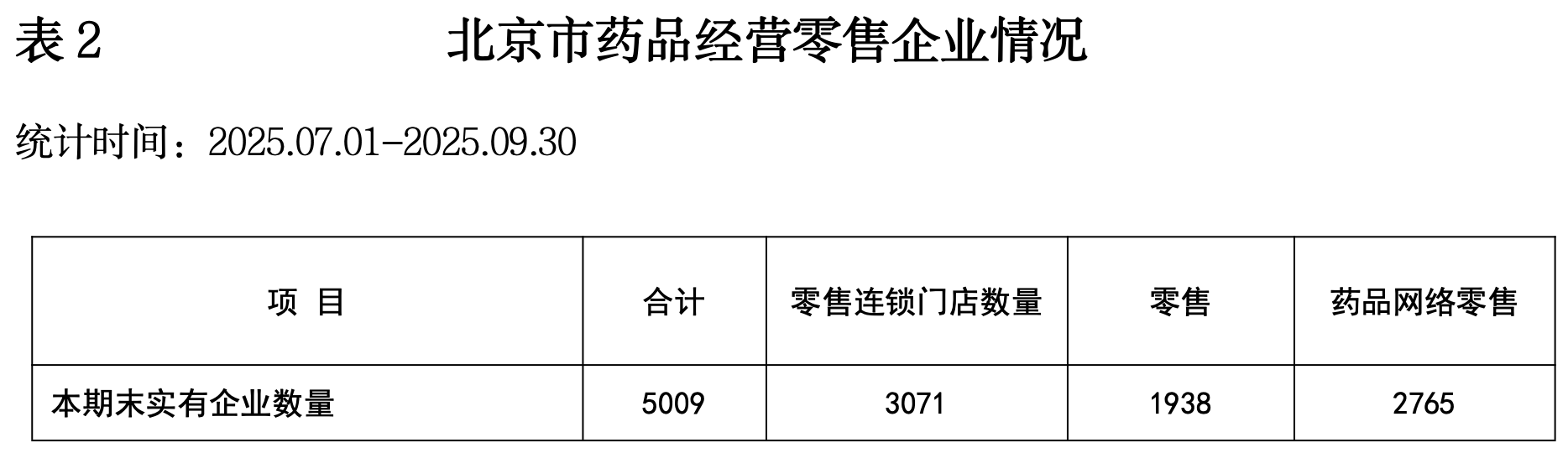
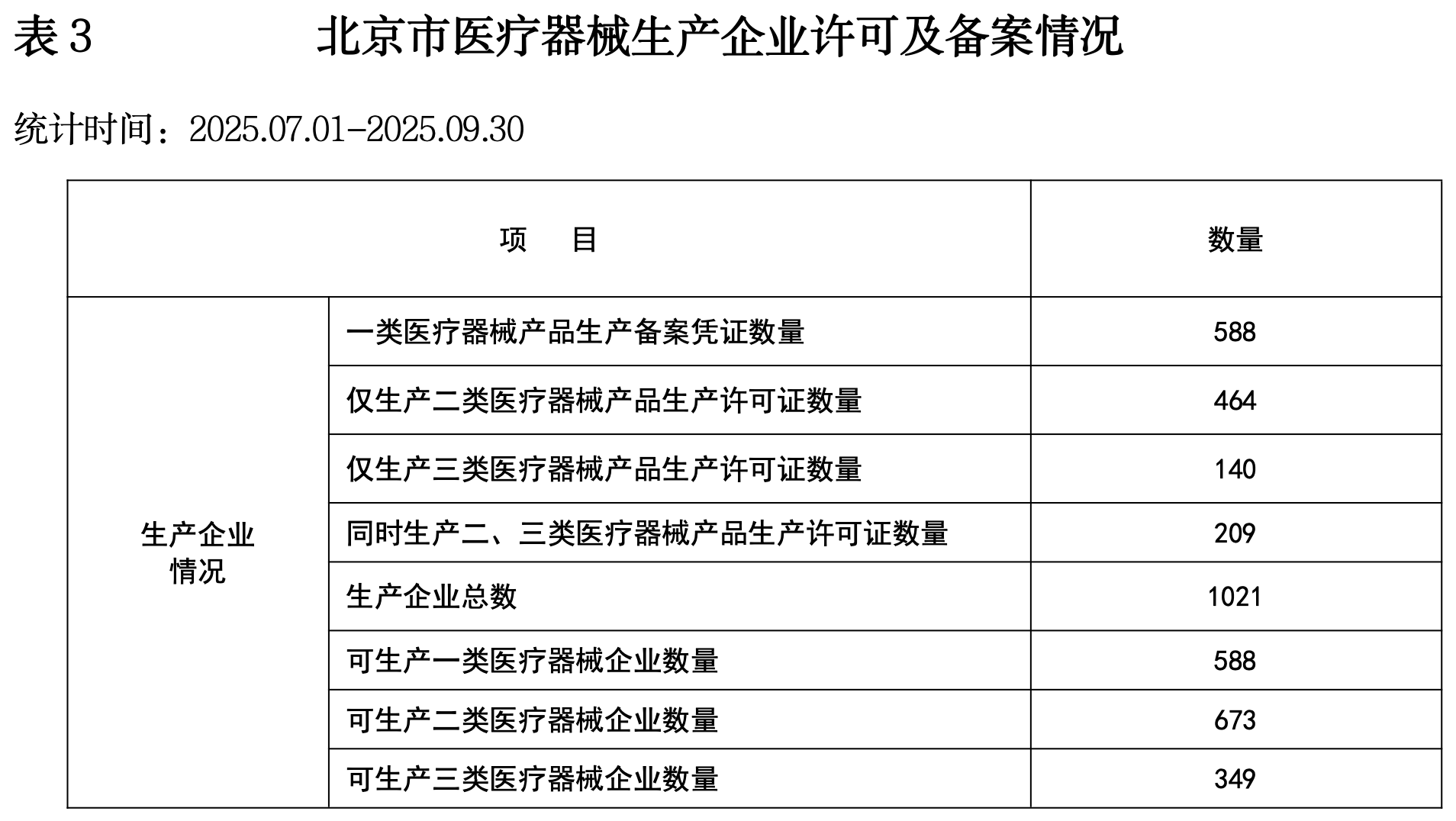
(一)2025年第三季度北京药品监督管理统计数据
网址:https://yjj.beijing.gov.cn/yjj/resource/cms/article/325752179/743813197/2025102811153548627.pdf

(二)北京市药品监督管理局关于组织本市药用辅料、药包材生产企业开展自查的通知
网址:
https://yjj.beijing.gov.cn/yjj/zwgk20/tz7/743815969/index.html
各药用辅料、药包材生产企业,各分局:
为加强药用辅料、药包材生产监管,推进落实《国家药监局关于发布〈药品生产质量管理规范(2010年修订)〉药用辅料附录、药包材附录的公告》(2025年第1号)(以下简称《公告》),我局组织全市药用辅料、药包材生产企业开展自查,现将有关事项通知如下:
一、自查范围
国家药监局药审中心原辅包登记平台信息上药用辅料、药包材登记状态为“A”的本市药用辅料、药包材生产企业。
二、自查内容
(一)在产企业的自查内容
各相关药用辅料、药包材生产企业应当分别对照药用辅料附录、药包材附录逐章节进行自查。
企业自查重点主要包括:符合企业实际的药用辅料或药包材质量管理体系建立情况、机构与人员、厂房与设施、设备、物料与产品、确认与验证、文件管理、生产管理、质量控制与质量保证、产品发运与召回、合同管理、《中国药典》(2025年版)执行情况等。药用辅料生产企业应当对照药用辅料生产企业自查清单(附件1)逐项开展自查,药包材生产企业应当对照药包材生产企业自查清单(附件2)逐项开展自查。
(二)停产企业的自查要求
产品登记状态为“A”的药用辅料、药包材全部停产且6个月内无恢复生产计划的生产企业,应当提交《**企业药用辅料/药包材停产报告》,报告包括但不限于以下内容:登记品种信息,国内是否有同类产品的信息;停产原因及计划恢复时间;企业承诺事项(恢复生产前应当进行全面自查,确保生产质量活动符合药用辅料、药包材附录要求,并书面报告属地分局);其他需要报告事项;企业联系人及联系电话。
三、自查报告提交时间及方式
各相关药用辅料、药包材生产企业应当于2025年11月28日前将法定代表人签字并加盖企业公章的自查报告、《药用辅料、药包材品种信息摸排表》(附件3)的纸质版和电子版提交至属地分局。各分局管辖区域及联系方式见附件4。
产品登记状态为“A”的药用辅料/药包材全部停产且6个月内无恢复生产计划的生产企业,应当于2025年11月28日前将法定代表人签字并加盖企业公章的停产报告纸质版和电子版提交至属地分局。
分局审核汇总相关情况,于2025年12月5日前将企业自查报告(电子版)、汇总后的《药用辅料、药包材品种信息摸排表》、汇总后的辖区企业自查发现问题及整改计划、停产企业停产报告(电子版)报送至市局药品生产处。
四、自查要求
(一)全面认真自查
各药用辅料、药包材生产企业应当高度重视本次自查工作,按照本通知要求对执行药品生产质量管理规范的情况进行全面梳理,将本次自查作为两个附录实施前最后的查缺补漏。对于自查发现的缺陷,应当全面评估风险,采取必要的纠正预防措施,确保缺陷整改到位。整改如果对药用辅料、药包材供应产生影响,应当与客户做好信息沟通。
(二)真实完整报告
本次提交的自查报告是企业监管档案的重要组成部分,也是监管部门开展风险研判、实施监督检查的重要依据,企业提交的自查报告内容应当真实、准确、完整。
产品登记状态为“A”的药用辅料、药包材全部停产且6个月内无恢复生产计划的生产企业,在恢复生产前应当开展全面自查,向属地分局提交自查报告。当前产品登记状态为“I”的药用辅料、药包材生产企业,在产品登记状态变更为“A”后,启动生产前应当开展全面自查,向属地分局提交自查报告。
(三)持续符合要求
药用辅料、药包材生产企业应当落实产品质量主体责任,持续完善质量管理体系,确保符合药用辅料附录、药包材附录的各项要求。严格按照在国家药监局药品审评中心原辅包登记平台登记的企业名称、生产地址、配方工艺等信息组织生产。建立健全变更管理体系,结合风险级别对变更开展充分研究并按规定更新登记信息。强化信息沟通,配合持有人开展供应商审计及其他质量活动,药包材、药用辅料的变更信息应当及时与持有人充分沟通。
特此通知。
附件:1.药用辅料生产企业自查清单
2.药包材生产企业自查清单
3.药用辅料、药包材品种信息摸排表
4.各分局管辖区域及联系方式
北京市药品监督管理局
2025年10月30日
(三)新增1个共性问题
网址:
https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/bjah-index-dept!detail.action?originalId=AH25102701009



四、辽宁省药品监督管理局
(一)辽宁省药品监督管理局关于 公开征求《辽宁省药品检查管理办法实施细则(药品生产)(征求意见稿)》意见的公告
网址:
https://ypjg.ln.gov.cn/ypjg/gzhd/yjzj/2025102910275114507/index.shtml

为规范药品生产监督检查工作,按照国家药监局《关于修订<药品检查管理办法(试行)>部分条款有关事宜的通知》(国药监药管〔2023〕26号)要求,我局于2023年12月5日印发了《关于修订<辽宁省药品检查管理办法实施细则(药品生产)(试行)>部分条款有关事宜的通知》(辽药监生〔2023〕64号)。
目前,《辽宁省药品检查管理办法实施细则(药品生产)(试行)》试行期将满,我局组织对《辽宁省药品检查管理办法实施细则(药品生产)(试行)》进行了再次修订(附件1),并拟转为正式文件(附件2),现向社会公开征求意见。
请于2025年11月5日前,将意见反馈表(附件3)发送至电子邮箱(yhscjgc.fda@ln.gov.cn),电子邮件请注明“《检查办法实施细则》意见反馈”。
特此公告。
附件:1.辽宁省药品检查管理办法实施细则(药品生产)(征
求意见稿)修订条款说明
2.辽宁省药品检查管理办法实施细则(药品生产)(征
求意见稿)
3.意见反馈表
辽宁省药品监督管理局
2025年10月27日
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容