2025-11-20 10:51:19来源:药方舟浏览量:1547
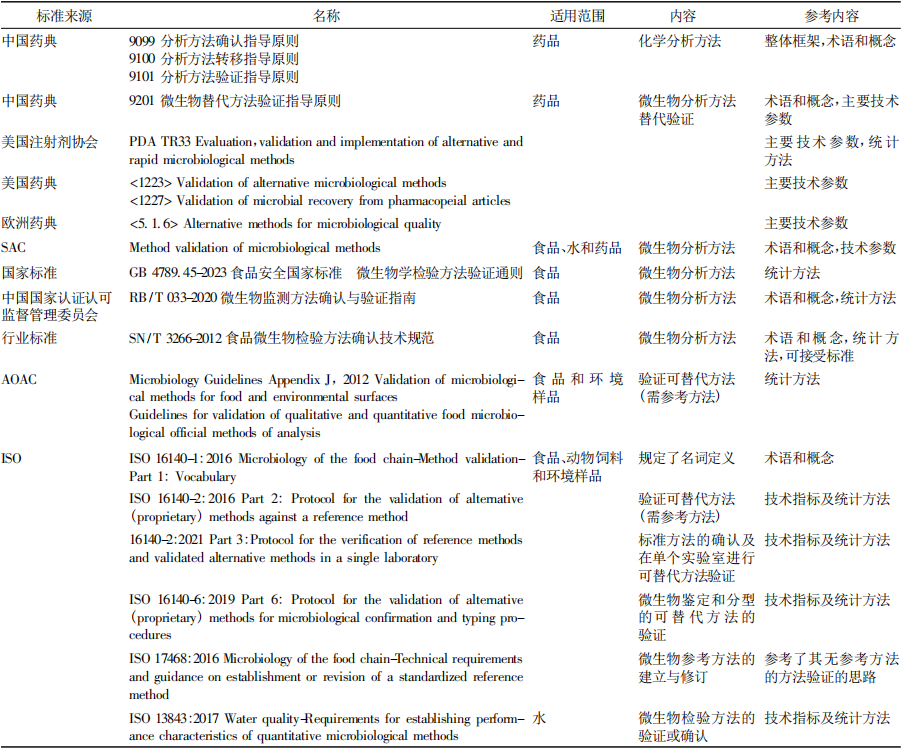
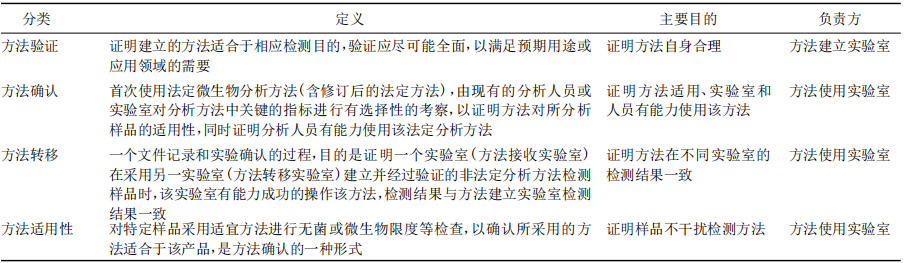
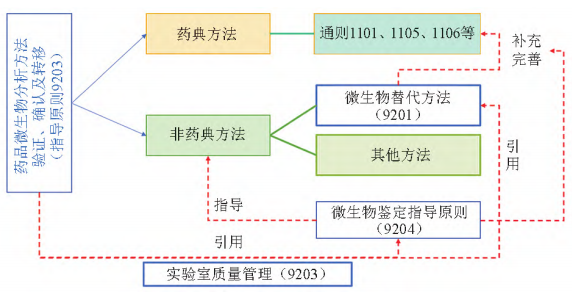
【摘要】2025 年版《中国药典》新增 9213“药品微生物分析方法验证、确认及转移指导原则”,从药品微生物分析方法的特点出发,结合应用实例,明确了开展药品微生物分析方法验证、确认及转移中的相关术语和应用场景,并通过引入关键统计工具、提出评价原则,确定了方法学考察的技术指标及可接受限度。本文系统阐述该指导原则的起草背景、起草过程,并对重点内容进行解读,以期为相关从业者应用该指导原则提供理论指导与实践参考。该指导原则夯实了我国药品微生物分析方法的基础,提升了药品微生物标准系统的科学性和准确性。 【关键词】微生物分析方法; 验证; 确认; 转移; 方法适用性试验 药物分析检测技术是保障药品安全性、有效性的重要防线。只有采用科学合理的分析方法,才能获得准确可靠的结果。科学地建立与使用分析方法需要进行适宜的方法学考察和评价。为此,2025 年版《中国药典》编制大纲明确提出“提升药品标准整体水平,进一步提高药品安全性、有效性保障,加强专属性强的检测方法及标准限度的制定,强化高风险品种安全性控制指标”的要求[1]。由于《中国药典》2020 年版已收载的分析方法验证、确认和转移指导原则不适用于微生物分析方法,“9213 药品微生物分析方法验证、确认及转移指导原则”( 简称指导原则 9213) 的制定,对支持新技术和新方法的发展、规范方法及标准的制修订、提升质量控制水平、保证微生物分析方法在药品领域的科学应用等具有重要意义[2]。本文介绍该指导原则的起草背景,并对其关键技术指标、标准适用范围及技术实施要点等内容进行解读。 1.1 标准现状 分析方法的验证、确认是保证检测结果准确可靠的基础,也是对检测实验室的通用要求。世界各国的认可机构,如澳大利亚认可委员会[3]( National Association of Testing Authorities,Australia,NATA) 、新加坡认可委[4]( Singapore Accreditation Council,SAC) 及中国合格评定国家认可委员会[5]( China National Accreditation Service for Conformity Assessment,CNAS) 等都发布有针对实验室进行分析方法验证和确认的基本要求,应用较广泛的标准有国际标准组织 ( International Organization for Standardization,ISO) 的 ISO 17025[6]、我国的国家标准 GB /T27025[7]等。同样,世界各国药品监管机构及行业组织等也要求对药品分析/检验方法应进行充分的验证或确认。 然而,国内外药品监管机构如美国食品药品监督管理局 ( U. S. Food and Drug Administration,FDA) [8]、欧洲药品监督管理局( European Medicines Agency,EMEA) [9]、人用药品注册技术要求国际协调会 ( International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH ) [10,11]、世界卫生组织( World Health Organization,WHO ) [12]、各国药典[13-14]包括《中国药典》2020 年版[15]等已发布的关于分析方法验证、转移、确认的相关法规和标准,都仅适用于理化分析方法,目前尚无具体针对药品微生物分析方法验证、确认及转移的相关法规和标准。由于影响药品微生物分析方法的因素较多,特别是样品中微生物分布的不均匀性,导致微生物试验分析方法本身存在较大的不确定度,因而,微生物分析方法较理化分析方法更复杂。目前,各国药典中仅在介绍微生物快速检测方法或替代方法时涉及部分与微生物分析方法验证相关的要求[16-19],覆盖不全面。 与此同时,相近领域如食品、环境微生物等,对分析方法的验证和确认要求日渐完善。我国早在2012 年即发布 SN/T 3266-2012《食品微生物检验方法确认技术规范》,近年来又更新了 RB /T 033-2020《微生物检测方法确认与验证指南》和 GB 4789. 45-2023《食品安全国家标准 微生物学检验方法验证通则》。国际上 ISO 17468[20]和 ISO 16140[21-25]系列标准,详细阐述了食品链的微生物检测新建/替代方法的验证和确认要求,包括实验内及实验室间验证和确认的参数、统计方法及 可接受限度。ISO13843[26]规定了对水中微生物定量方法的确认要求。美国分析化学家协会( Association of Official Agricultural Chemists,AOAC) [27]也发布有针对食品、环境相关的微生物检测方法验证指导原则。 1.2 我国的行业现状 伴随着微生物检验理念和技术的进步,制药领域不断引入新的微生物分析方法,但如何判断所选择的方法是否适合于相应的检验目的? 如何判断或证明一个微生物检验实验室是否具备相应的检测能力? 成为亟待解决的新问题。同时,在对药品微生物分析方法的应用现状进行调研时发现,业内对微生物分析方法涉及的相关术语和内涵理解不正确,常将“方法验证”“方法确认”“方法转移”和“方法适用性( suitability testing) ”等概念混淆。因而,亟须建立相应的技术要求,指导如何对微生物分析方法进行验证、确认及转移,进而规范微生物分析方法的应用。 从标准起草的规范性和科学性出发,通过梳理国内外与分析方法相关的标准、法规,重点参考相近领域微生物分析方法的参数设置及统计方法( 表1) ,同时结合当前我国的标准现状、执行过程中行业的反馈意见和药品微生物分析方法的需求开展起草工作。为保证分析结果的准确性和相关参数设置的科学性,分别通过开展药品微生物定性分析方法和定量分析方法的实例研究,组织实验室内和实验室间的复核检验,探讨技术指标设置的合理性及指导原则的实际应用场景。 ▲表1-指导原则 9213 起草中参考的相关标准 3.1 主要框架 参照《中国药典》2020 年版四部通则 9099、9100、9101 及 9201 的体例,指导原则 9213 整体分为三部分,分别为药品微生物分析方法验证、方法确认和方法转移( 表 2) 。 ▲表2-指导原则框架和内容要点 3.2 指导原则 9213 中的关键点 3.2.1 术语标准化 方法适用性与方法验证、方法确认、方法转移等概念既相互联系又有区别[28],目的都为了保证检测方法的准确可靠,但由于检测目的、检测对象、检测人员、检测条件等因素的不同,以上几个概念的内涵和侧重点又有所不同( 表3) 。指导原则 9213 明确了药品微生物分析方法的验证、确认、转移等相关定义。 ▲表3-术语的联系与区别 3.2.2 具体使用情境 指导原则 9213 首次明确了药品微生物分析方法验证、确认及转移等的适用情境,包括但不限于以下示例( 表 4) 。方法验证侧重于新方法的开发与方法修订等环节。方法确认根据应用场景要求有所不同: 对从未进行过药品微生物分析的新建实验室,建议参考指导原则表 2“微生物分析方法确认推荐参数”对定性或定量方法进行确认; 对已长期开展无菌或微生物限度检查的实验室,仍可按药典通则 1101、通则 1105 等中的方法适用性试验对具体品种进行无菌或微生物限度检查方法的确认。上述通则中的方法适用性试验是方法确认的一种具体形式。 ▲表4-微生物方法验证、确认、转移和方法适用性的使用情境示例 3.2.3 参数科学量化 指导原则 9213 为推荐性指导原则,所列参数供方法开发者或使用者综合评估后使用。在进行方法验证时,一般定性方法至少选择检测限,定量方法至少选择准确度进行实验室间验证。 检测限: 首次引入配对与非配对分析模型,解决“无参考方法”的检测限验证的难题。同时,推荐了POD( probability of detection) 等适宜统计方法,与国际标准体系接轨。 准确度: 在保留传统的回收率基础上,增加了统计参数容忍区间。该统计参数联合评估方法的精密度和重复性,使统计结果更加科学。 不确定度: 首次提出必要时微生物定量方法需评定其不确定度,涵盖样品因素( 质量和体积等) 和非样品等因素( 操作者、时间、设备、培养基和试剂等) 。 3.3 与药典其他相关通则的关系 指导原则 9213 作为微生物分析方法的基础,与《中国药典》多个通则和指导原则紧密联系( 图 1) ,应参考协调使用。 ▲图1-《中国药典》现有部分微生物相关通则的关系 对替代以培养为基础的经典微生物检验方法的验证,可参照药品微生物检验替代方法验证指导原则( 指导原则 9201) 实施。微生物鉴定方法的验证和确认按微生物鉴定指导原则( 指导原则 9204)实施。 首次使用法定方法进行检验时,应首先确保实验室的人员、仪器设备等满足药品微生物实验室质量管理指导原则( 指导原则 9203) 的相关要求。经评估实验室及分析人员有能力开展微生物法定分析后,方可采用该法定方法进行试验。对按照无菌检查法( 通则 1101) 、非无菌产品微生物限度检查: 微生物计数法( 通则 1105) 、非无菌产品微生物限度检查: 控制菌检查法( 通则 1106) 或中药饮片微生物限度检查法( 通则 1108) 进行检验的具体品种,可按相应通则中的方法适用性试验进行方法确认。 方法验证、确认和转移是一项系统、科学、复杂的工作。微生物分析方法的检测对象是微生物活体,存在更多的不确定性,因而困难更多,要求更高。指导原则 9213 在坚持科学性的基础上,注重可操作性,可作为方法开发机构、药品生产企业、检验检测等进行微生物分析方法验证、确认及转移的重要参考依据。 2025 年版《中国药典》新增的指导原则 9213是各国药典中首个针对微生物分析方法的指导原则,其率先明确了药品微生物分析方法验证、确认、转移的定义,确定了方法学考察的统计方法、技术指标及可接受限度,为微生物实验室建立 /选择适宜的分析方法提供了解决方案。该指导原则的颁布将有助于推动新药品微生物分析方法的应用,提升药品微生物分析的水平,进而促进我国药品微生物标准的提升。 参考文献