2025-12-24 10:25:47来源: 注册圈浏览量:495
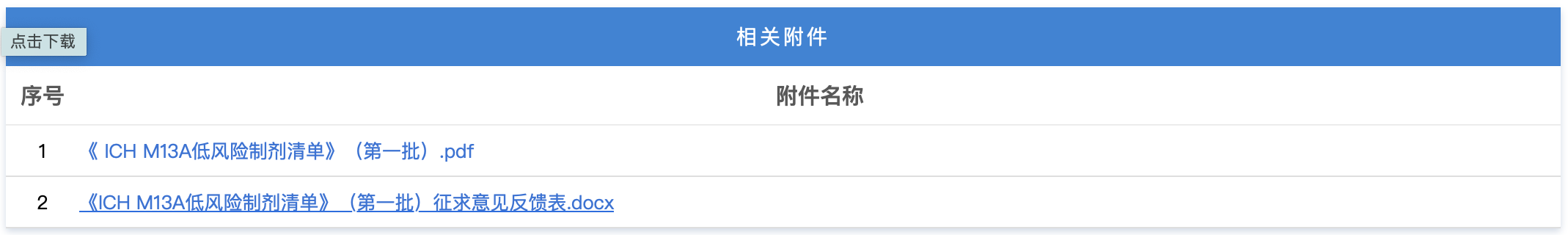
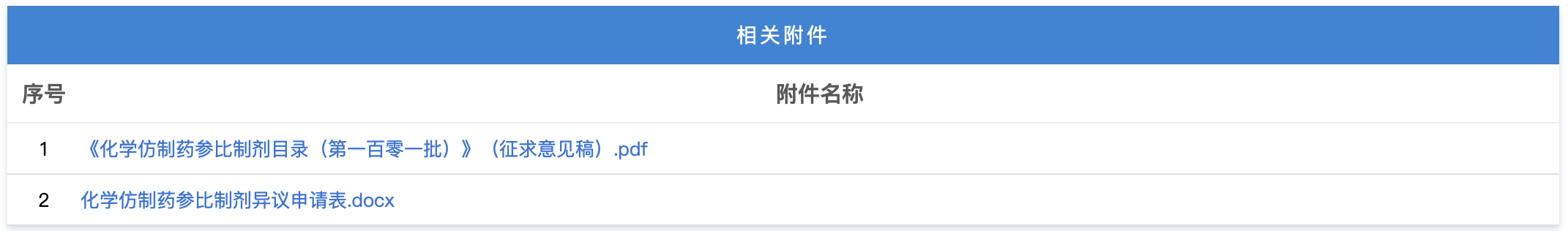
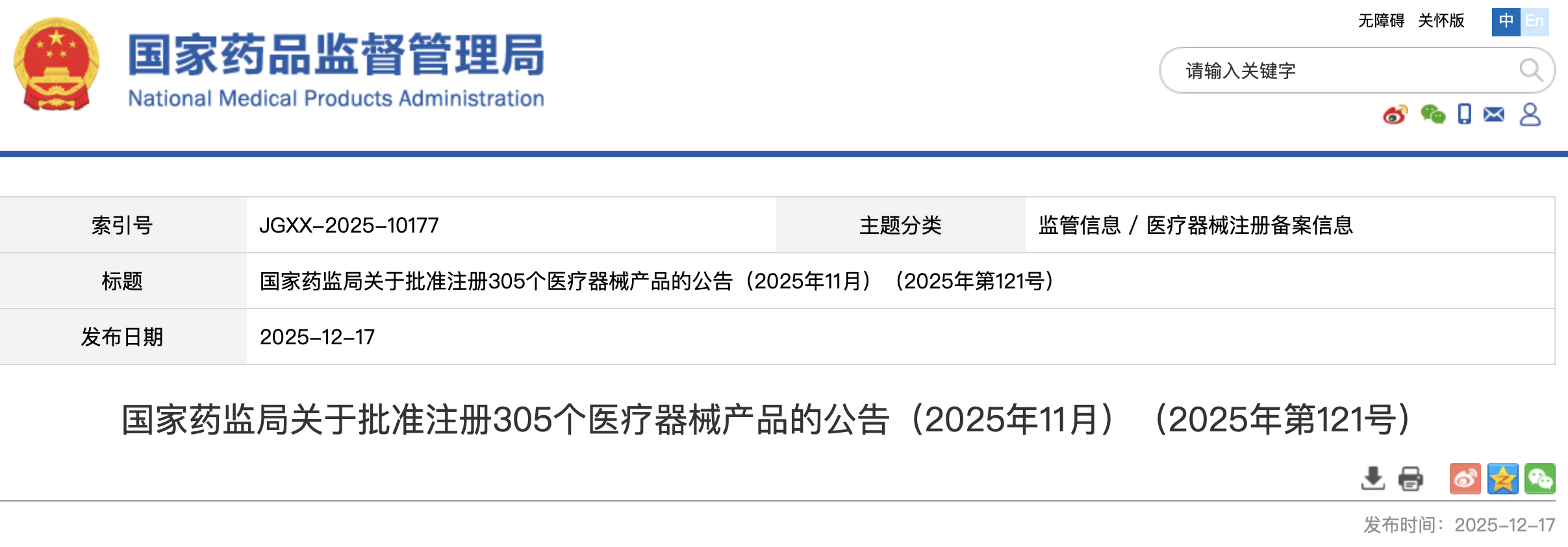
https://www.cde.org.cn/main/news/viewInfoCommon/a2356fcbee66adde2dde5418c09b0f3e 为贯彻落实《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》(国办发〔2024〕53号)相关要求,促进滴眼剂化学仿制药质量提升,经广泛调研和讨论,我中心起草了《化学仿制药滴眼剂研究技术指导原则(征求意见稿)》和《化学仿制药特殊滴眼剂研究技术指导原则(征求意见稿)》,现公开征求意见。 我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。 您的反馈意见请以意见反馈表形式发到以下联系人的邮箱: 联系人:罗俊永,李珊珊 联系方式: luojy@cde.org.cn,lishsh@cde.org.cn 感谢您的参与和大力支持。 国家药品监督管理局药品审评中心 2025年12月15日 https://www.cde.org.cn/main/news/viewInfoCommon/073444189bbfbfb6e72f4373cc9ba33f 为落实ICH《M13A口服固体速释制剂的生物等效性》中制剂风险评估原则,指导企业提高研发效率,同时参考国际其他监管机构的技术要求,我中心拟定了M13A低风险制剂清单(第一批,见附件),现公开征求意见。征求意见时限为2025年12月15日至12月19日。 请将反馈意见通过电子邮箱反馈。 联系人:任曼茹,韩鸿璨 邮箱:renmr@cde.org.cn; hanhc@cde.org.cn 国家药品监督管理局药品审评中心 2025年12月15日 https://www.cde.org.cn/main/news/viewInfoCommon/e0d4e720d32a9d273cdaad8254f4711d 根据国家局2019年3月28日发布的《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号),我中心组织遴选了第一百零一批参比制剂(见附件),现予以公示征求意见。 公示期间,请通过参比制剂遴选申请平台下“参比制剂存疑品种申请”模块向药审中心进行反馈,为更好地服务申请人,反馈意见请提供充分依据和论证材料,反馈材料应加盖单位公章,并提供真实姓名和联系方式。 公示期限:2025年12月19日~2026年1月4日(10个工作日)。 国家药品监督管理局药品审评中心 2025年12月19日 https://www.cde.org.cn/main/newspic/view/238c3f37fcef27d5883b97e73d13276a 为全面落实《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》(国办发〔2024〕53号)部署要求,促进放射性药品创新发展。12月9日,国家药监局药审中心联合药品长三角分中心、浙江省药监局在杭州共同举办了“聚焦共性问题 促进化学放射性药品创新发展”宣贯培训。来自全国各地的药品研发生产企业、科研机构以及药品监管部门,技术审评、核查检验相关单位代表等近300人参加了此次培训。 本次培训在前期调研企业需求的基础上,精心设计了培训课程。来自药审中心、中检院和特药检查中心的6位讲者围绕化学放射性药品新药和仿制药药学审评常见问题和考虑、临床审评常见问题和考虑、非临床评价策略和关注点、注册核查检验常见共性问题等方面进行培训解读。课程内容丰富、针对性强。 在答疑环节,围绕化学放射性药品的研发与生产进行了深入交流和讨论,针对参会企业提问提供了专业技术指导,帮助企业解决研发和申报阶段遇到的实际问题。 https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20251216161250165.html https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20251217091719196.html 经查,康维宁(重庆)医疗科技有限公司申报“外周可调弯导引导管”医疗器械注册时存在提供虚假资料行为,依据《医疗器械监督管理条例》第八十三条的规定,决定撤销康维宁(重庆)医疗科技有限公司外周可调弯导引导管(注册证编号:国械注准20243030194)注册证。 特此公告。 国家药监局 2025年12月16日 https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxpzhzhcchpgg/20251217154129166.html 2025年11月,国家药监局共批准注册医疗器械产品305个。其中,境内第三类医疗器械产品237个,进口第三类医疗器械产品43个,进口第二类医疗器械产品22个,港澳台医疗器械产品3个(具体产品见附件)。 特此公告。 附件:2025年11月批准注册医疗器械产品目录 国家药监局 2025年12月15日 https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20251217175129135.html 2023年8月25日,国家药监局发布《关于适用〈Q12:药品生命周期管理的技术和监管考虑〉国际人用药品注册技术协调会指导原则的公告》(2023年第108号)。为继续推动药品注册技术标准与国际接轨,现就适用该项技术指导原则(以下简称ICH Q12)的有关事项进一步公告如下: 一、对于ICH Q12中提供的监管工具批准后药学变更管理方案(PACMP),国家药监局药品审评中心已发布《化学药品批准后药学变更管理方案技术指导原则(试行)》,并将根据国际上执行ICH Q12的进展情况,陆续发布其他技术指导原则。申请人在提交上市申请时可以一并提出PACMP有关申请,或在上市后直接提出PACMP补充申请。 二、药品上市后发生药学变更时,药品上市许可持有人拟降低技术指导原则中明确的变更管理类别的,应当按照ICH Q12及PACMP等技术指导原则要求,经批准后执行。 三、对于ICH Q12中提供的其他监管工具,如既定条件(EC)、产品生命周期管理(PLCM)等,国家药监局将持续跟进国际进展,及时借鉴国际经验,组织工业界开展研究,积极推动新方法、新工具的转化应用。如申请人确有需求、拟采用EC、PLCM等工具进行变更管理的,应当在提交注册申请前与国家药监局药品审评中心进行沟通交流。 本公告自发布之日起实施。其他已发布文件与本公告不一致的,以本公告为准。 特此公告。 国家药监局 2025年12月12日 https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20251219151833196.html https://www.cfdi.org.cn/cfdi/resource/news/16609.html 为指导检查员开展化学原料药连续制造的检查,提升现场检查能力,国家药监局核查中心组织起草了《化学原料药连续制造检查指南(征求意见稿)》,现面向社会公开征求意见。 请于2026年1月20日前填写意见反馈表并发送至以下邮箱,邮件标题请注明“化学原料药连续制造检查指南(征求意见稿)”。 邮箱:zhanjinbao@cfdi.org.cn 附件:1.化学原料药连续制造检查指南(征求意见).pdf 2.意见反馈表.docx 国家药品监督管理局食品药品审核查验中心 (一)浙江省药品监督管理局关于颁布金线莲中药材标准和饮片炮制规范的通告 网址: https://mpa.zj.gov.cn/art/2025/12/19/art_1228989285_58943113.html 根据《中华人民共和国药品管理法》《国家药品监督管理局关于发布省级中药饮片炮制规范修订的技术指导原则的通告》(2018年第16号)和《国家药监局 国家中医药局关于发布<地区性民间习用药材管理办法>的公告》(2024年第61号),我局对企业申报的金线莲中药材标准和饮片炮制规范进行了审核,现予以颁布,自2026年2月1日起施行。 特此通告。 浙江省药品监督管理局 2025年12月17日 浙江省药品监督管理局关于颁布金线莲中药材标准和饮片炮制规范的通告 (一)新增1个共性问答 网址: https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/bjah-index-dept!detail.action?originalId=AH25121601163









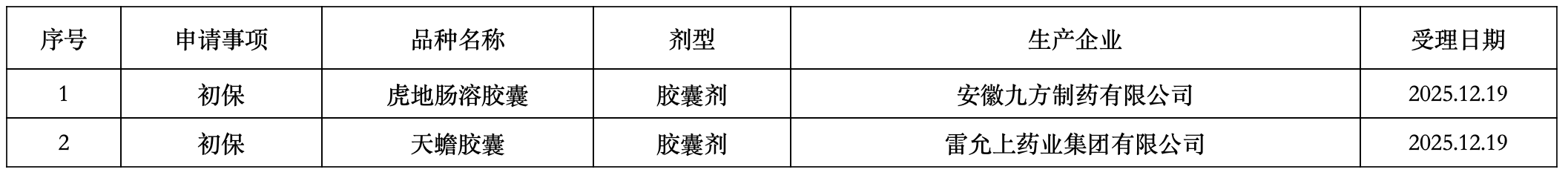

2025年12月18日