
2026-01-15 09:16:44来源:注册圈浏览量:273
【摘要】目的:总结分析质量源于设计(Quality by Design,QbD)理念在口腔膜剂的处方设计与评价中的应用,以期为研究者提供参考。方法:结合QbD的主要元素、实施步骤及辅助工具和基于QbD的口腔膜剂研发实例,对口腔膜剂的目标产品质量概况、关键物料属性、关键工艺参数及关键质量参数等信息进行梳理。结果与结论:QbD是一种具有明确目标的,基于质量风险管理及科学可靠的产品和工艺开发的理念,包括确定目标产品质量概况和关键质量属性、风险评估、实验设计、设计空间控制策略和过程分析。口腔膜剂具有溶化快速、使用方便、剂量准确、便于携带等特点,服用时无需用水送服,适用于有特殊需求的人群,如用于治疗精神病、精神分裂症、躁狂症以及吞咽困难患者。QbD理念在常规剂型研发中应用较多,在口腔膜剂研发中应用的相关研究较少。与传统方法相比,QbD更多应用风险管理的科学知识,识别影响关键质量属性的关键物料属性和关键工艺参数的操作空间,并持续进行全生命周期管理,更有利于生产和监管部门了解产品的生产工艺及相关变更信息。
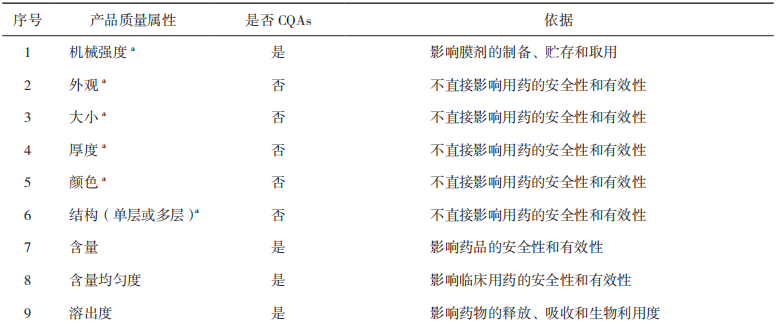
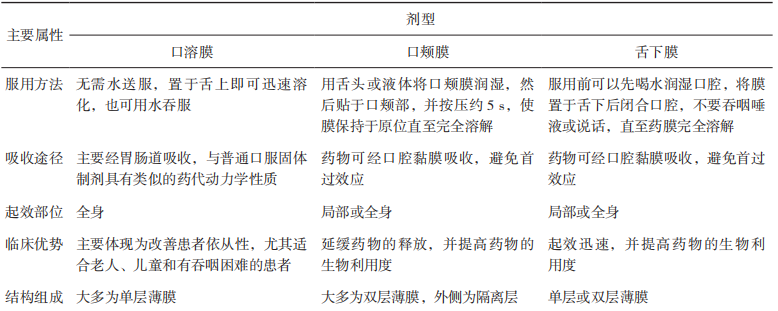
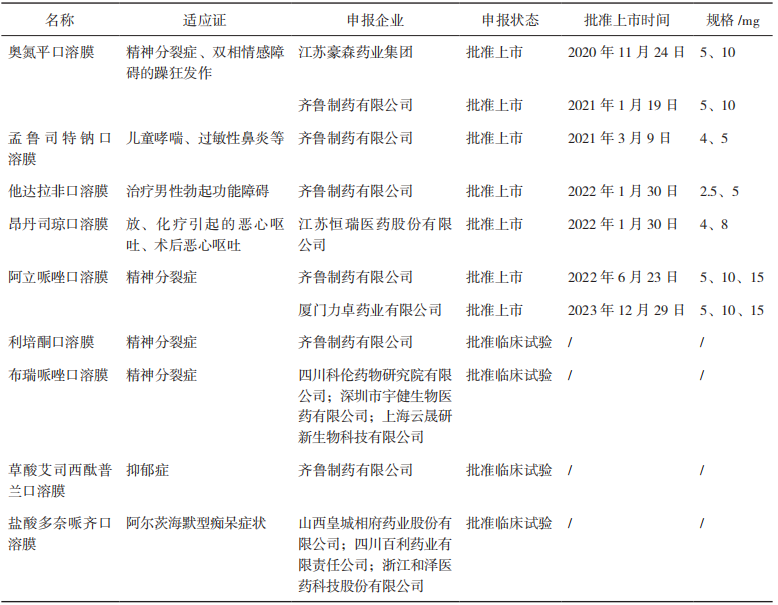
【关键词】质量源于设计;口腔膜剂;目标产品质量概况;关键质量属性;关键物料属性;关键工艺参数 质量源于设计(Quality by Design,QbD)理念在21世纪初由美国食品药品管理局(FDA)引入制药行业[1],随后人用药品注册技术要求国际协调会(ICH)出台了药物开发(ICHQ8)[2]、质量风险管理(ICH Q9)[3]和药物质量体系(ICH Q10)[4]等相关指南,详细阐述了QbD理念。作为一种系统的药物开发方法,QbD以预定义的产品目标为起点,以科学的质量风险管理为基础,强调对产品生产的过程控制[5]。 口腔膜剂作为一种新型膜状口服固体制剂,近年来在国内外得到广泛应用,与传统的片剂、胶囊、丸剂等口服固体制剂比较,口腔膜剂具有无需用水送服,不必担心会噎住或吸入,生产工艺简单和成本较低等优势;与口服液体制剂比较,具有分剂量准确且便于携带等优势[6]。尤其适用于老人、儿童、吞咽困难的患者和一些自主行为不受控制的有精神系统障碍的患者。对于通过颊膜、舌下膜吸收的口腔膜剂,还可避免首过效应。若采用适宜的成膜材料可以延缓药物的释放,减少给药频率和给药剂量。另外,由于膜剂特殊的单剂量包装,可有效隔绝空气和水分,具备良好的化学稳定性,因此,越来越多的药物被开发成此剂型并推向市场,口腔膜剂具有良好的市场前景[7]。 尽管QbD的理念和优势已被广泛接受,但其在制药行业中的应用尚未被完全开发,Grangeia等[5]的调查研究显示,QbD方法主要应用于常规制剂。目前对基于QbD的口腔膜剂产品开发尚不充分,本文通过梳理QbD的主要元素、实施步骤、辅助工具及各国药典中口腔膜剂的收载情况,概述了QbD在口腔膜剂研发中的应用,并对国内外已上市的部分口腔膜剂进行了总结。 QbD理念是指药品质量不依赖于产品的最终检测,而需通过评估和细化生产工艺,确定关键物料属性(Critical Material Atributes,CMAs)及关键工艺参数(Critical Process Parameters,CPPs)与关键质量属性(Critical Quality Attributes,CQAs)的关系,创建工艺设计空间(Design Space),结合质量风险评估(Risk Assessment,RA)建立更优的控制策略,为产品生产和质量控制提供保证,使产品生产过程在批准的设计空间内进行工艺变更,无需额外进行监管批准,从而实现灵活的工艺控制,主要包括定义目标产品质量概况(QualityTarget Product Profile,QTPP)和CQAs,通过RA确定CMAs和CPPs,通过实验设计(Design ofExpeniment,DoE)界定CMAs、CPPs和CQAs之间的函数关系,确定设计空间和控制空间(ControlSpace)以获得最优产品,同时应用过程分析技术(Process Analytical Technology,PAT)通过对关键参数的实时监测来确保生产处于设计空间内[2-4]。 1.1 QTPP和CQAs 明确QTPP是实施QbD的第一步。ICHQ8将QTPP定义为“从理论上达到对药品质量特性的前瞻性总结,确保预期的质量,同时兼顾药品的安全性和有效性”[2]。FDA发布了简略新药申请(Abbreviated New Drug Application,ANDA)的QbD[8-9],介绍了开发早期由原研产品特点、说明书、质量标准及临床给药特点等方面总结 QTPP 的方法。同样地,在开发口腔膜剂的过程中,QTPP可以从剂型、规格、给药途径、药动学、稳定性等方面入手。以上这些质量要求被称为质量属性(Quality Attributes,QA),其中受制剂处方或生产工艺等变动影响较大的 CQAs 是药物开发过程的研究重点。表 1 对口腔膜剂的 QTPP 要素进行了分析和说明。 ▲表1-口腔膜剂的 QTPP 要素和说明 为了保证药品质量的安全、有效、可控,口腔膜剂的质量研究及控制需要结合剂型特点进行确定,除了要包含与普通口服制剂相同的常规检查项目,如鉴别、含量、含量均匀度、有关物质、微生物限度外,还要有特殊的控制指标,如性状、机械性能、溶化时限、溶出度等。其中机械性能指标(如耐折度、断裂强度、抗拉强度等)和生物学特性指标(如崩解时限/溶化时限、溶出度、刺激性等)需要特别关注[10]。表2基于产品在不符合某项质量属性时对患者可能造成危害的严重程度,分析了口腔膜剂的CQAs¹[11-12]。根据口腔膜剂的特点及CQAs,建议重点关注口腔膜剂的口感、水分、溶化时限、溶出度以及机械性能。 ▲表2-口腔膜剂的 CQAs 适口性:口腔膜剂应口感良好,为了满足依从性要求,建议在临床研究过程中关注给药方式(口腔中的放置位置、溶化时限等)、黏膜黏附性和刺激性、口腔局部不良反应、口感评价等[13]。 水分残留:口腔膜剂中应含有适量的水分,以保障口腔膜剂具有适宜的机械性能,避免包装、运输过程中发生磨损或破碎。 溶化时限:《中华人民共和国药典》2020年版膜剂通则项下并未规定溶化时限检查的相关要求,但溶化时限是口腔膜剂药学质量研究及控制中需关注的重要指标之一。在注册检验工作中,发现部分药品生产企业参考口崩片的检查方法和限度拟定口腔膜剂的相关方法和限度,如采用900mL水作为介质,与口腔膜剂在口腔内的实际使用环境有较大差异。因此建议模拟口腔膜剂使用方法及口腔环境,建立可行的溶化时限检查方法(少量溶剂),结合临床试验中在受试者口腔中的溶化时限及相关性考察,为方法及限度提供合理依据。 溶出度:在口腔膜剂开发的初期风险评估中,溶出度通常是高风险质量属性,应重点关注。在开展口腔膜剂溶出度方法开发时,建议考虑口腔膜剂质轻易漂浮等制剂特点,关注溶出装置、溶出试验参数、取样时间点等选择的合理性,建立合适的、具有一定区分能力的溶出度检查方法。在证明溶出方法区分能力时,可制备CMAs、CPPs和关键处方组成发生变化(例如参数在设定值±10%的变化)的样品,提供不同样品溶出曲线对比数据[14]。对于难溶性药物制备的口腔膜剂,建议建立的溶出度检查方法对不同粒径的处方具有一定的区分能力[14]。 机械强度:机械性能在口腔膜剂的给药便利性和稳定性方面均有重要影响[10]。建议根据口腔膜剂的临床使用场景和特点,关注产品商业包装和运输装载方式,进行模拟装载、运输、随身携带(可能涉及跌落、撞击、皱褶等情况)的研究,对可能产生的膜片碎裂等情况进行考察。口腔膜剂机械性能的评价指标可参考但不限于以下项目[10,14]:(1)伸长率(Elongation Percent):当施加拉力时,薄膜样品会拉伸产生形变。伸长率为薄膜伸长量占原来长度的百分率。薄膜伸长率一般随增塑剂含量的增加而增加;(2)杨氏模量(Young's Modulus):杨氏模量也称弹性模量是衡量薄膜刚度的参数,表示为弹性变形区域的应力与应变之比;(3)抗拉强度(Tensile Strength):是薄膜样品在某一点断裂时施加的最大应力,计算方式为用断裂时施加的力除以薄膜的横截面积;(4)抗撕裂性(TearResistance):是撕裂薄膜所需的最大力,记录为抗撕裂值(单位为牛顿或磅);(5)耐折度(FoldingEndurance):耐折度是通过将薄膜在同一位置反复折叠直至薄膜破裂来确定的,薄膜折叠不断裂的次数计为耐折度值。耐折度可用于模拟临床实际使用、运输、贮藏过程对薄膜性能的影响。建议结合口腔膜剂生产工艺过程控制、稳定性过程中的机械性能研究结果,合理拟定可接受标准,并考虑是否订入质量标准[15]。 1.2 风险评估和确定CMAs和CPPs 在建立了目标产品的QTPP和CQAs后,需要对处方变量和工艺参数进行风险评估,确定CMAs和CPPs。风险评估是实施QbD的重要工具,也是质量风险管理的第一步,这一过程包括识别、分析和评估,用于识别风险发生的可能性及其后果和严重程度[3]。常见的风险评估工具包括:石川图/鱼骨图、失效模式及后果分析(Failure Mode andEffects Analysis,FMEA)、故障树形图分析、危害分析和关键控制点分析等[3]。CMAs指处方中每种物料自身需控制的物理、化学或生物特征,口腔膜剂的CMAs包括活性成分(Active PharmaceuticalIngredient,API)的粒度分布、晶型、杂质谱、溶解度;成膜材料的黏度等级、粒度分布、水分含量;增塑剂的纯度、水分含量、黏度等属性。Thabet等[16]根据ICH的相关指南,针对口腔膜剂从实验室规模到连续生产过程的开发给出了石川图,该研究结果显示,将口腔膜剂制备工艺从实验室规模转化到连续工业化生产规模时,黏度和干燥温度属于CPPs,需要根据具体产品仔细选择这些参数。如果选择不当,会导致薄膜的机械性能不稳定,还会使薄膜中产生气泡,在采用较高干燥温度(大于120℃)时这种情况较常发生。Visser等[17]在对临时制备的口腔膜剂进行研究时,首先基于目标产品确定并量化CQAs,即机械性能和崩解时间,确定了聚合物百分比、增塑剂比例及干燥时间等为CPPs,同时运用响应面法研究这些CPPs对CQAs的影响。结果显示,制备口腔膜剂时所用的甘油百分比对抗拉强度和杨氏模量有直接影响,聚合物[羟丙甲纤维素(HPMC)]含量会影响口腔膜剂的崩解时间,干燥温度会影响伸长率。总体而言,此项研究提供了一个设计空间,在这个空间内,工艺参数可以在一定范围内变动,均能制备出高质量的口腔膜剂。 1.2.1 口腔膜剂的处方组成 口腔膜剂的处方组成主要包括活性成分、成膜材料和增塑剂。此外,出于加快口腔膜剂的崩解速率,改善口感和外观,以及提高产品稳定性等的考虑,还会增加崩解剂、矫味剂、着色剂、稳定剂和表面活性剂等其他组分。表3总结了口腔膜剂的典型处方组成[18]。在口腔膜剂的配方和开发过程中所使用的所有辅料均被认为是安全的(已列入公认安全物质清单),从监管角度来看,应允许其用于口服药物制剂[19]。 ▲表3-口腔膜剂的典型处方组成 API的基本性质,如溶解性、晶型、粒度和生物药剂学分类系统(Biopharmaceutical ClassificationSystem,BCS)等都可能对制剂质量产生影响。理想的膜剂API特征包括低剂量、口感好、分子量小、在唾液中溶解度大且稳定性好。水溶性API通常不存在分布均匀性的问题。不溶于水的API可通过研磨、微粉化或以纳米晶体或微胶囊等形式添加以保持分布均匀[20-21]。许多API具有苦味,对儿童来说难以接受,如利培酮、阿立哌唑味苦,可以选择加入矫味剂进行掩味以改善口感[22];如原料药口感极苦,刺激性较强,或剂量较大,通常不建议开发成口腔膜剂。 成膜材料是口腔膜剂中主要的骨架材料,多为高分子亲水性材料,具有良好的延展性、物理性能和适宜的黏度,能够快速溶解或溶胀,通常包括纤维素类衍生物、合成高分子材料类,如HPMC、羟丙纤维素、聚乙烯醇、聚氧乙烯、聚维酮、明胶、黄原胶等[23]。成膜剂的种类和用量对口腔膜剂的载药量、外观、机械性能、溶化时限、溶出度等均有影响。理想的成膜材料应具备以下特征:无毒,无刺激性,口感好,能保持长期稳定性,不改变处方中API和其他辅料的性质,有良好的润湿性和延展性,不会延长膜的溶化时间且具有最佳剥离强度和拉伸强度[24]。 增塑剂也是膜剂处方中的重要组成成分,可降低成膜剂的玻璃化转变温度,改善口腔膜剂的柔韧性,提高药膜的机械性能,对溶化时限、溶出度等均有影响[25],有利于膜剂的裁切、包装,使之便于贮存、服用。常用的增塑剂主要包括聚乙二醇、甘油、丙二醇、聚山梨酯等。增塑剂能改变口腔膜剂的机械性能,若其用量不当会导致膜的开裂和剥离,甚至一些增塑剂会影响药物的吸收速率[26]。 口腔膜剂辅料成分还可选择性地添加甜味剂、唾液刺激剂、表面活性剂以及着色剂等辅料。口腔膜剂应口感良好,对口腔黏膜无刺激性。在口腔膜剂的处方开发中,需要特别关注外观和适口性。根据依从性的需要,可添加矫味剂或采用合适的掩味技术改善口感,例如一些原料药的适口性不佳,对儿童患者来说特别难以接受,可用矫味剂或包合技术来调节口腔膜剂的口味,掩盖不良气味,提升口感。常用的矫味剂包括三氯蔗糖、阿司帕坦等。口腔膜剂的外观应完整、光洁、薄厚一致、色泽均匀、无明显气泡。为了改善一些难溶性原料药的分散均匀性,通常需要加入表面活性剂来避免原料药的团聚。另外,如果处方中使用稳定剂、抗氧剂等辅料,需提供合理依据[23]。 1.2.2 口腔膜剂的制备方法 口腔膜剂的制备方法有溶液浇铸法(SolventCasting,SC,又称“流延法”“涂布法”)、热熔挤出法(Hot-Melt Extrusion,HME)、半固体浇铸法(Semisdlid Casting, SSC)、静电纺丝法(Flectnospinning)、2D/3D打印(2D or 3D Printing)等,其中最常用的方法是溶液浇铸法和热熔挤出法。近年来,静电纺丝法、2D/3D 打印等新技术也得到了较好的发展。Lee等[27]和Musazzi等[28]对用于口腔膜剂生产的不同技术进行了全面综述。Turkovi等[29]对2008年11月至2022年4月发表的112篇口腔膜剂相关文献进行数据采集和分析,发现在许多研究中,采用了2种或多种制造方法,最常用的方法是溶液浇铸法,在Turkovi等分析的112篇文章中有123项研究采用了溶液浇铸法,其次分别是3D打印(12项研究)、2D打印(10项研究)、静电纺丝法(8项研究)和热熔挤出法(2项研究)。表4对口腔膜剂的部分制备方法的优缺点进行了比较。 ▲表4-口腔膜剂的部分制备方法的优缺点 溶液浇铸法是一种广泛应用于聚合物薄膜制备的方法,所获得的薄膜可以包括选定的原料药,或者可以制备为无药膜,用作2D打印的基材。虽然可以使用不同的溶剂铸造方法,但它们都基于相同的步骤:(1)在所选的液体载体中制备含有成膜剂和其他成分的分散体;(2)铸造;(3)薄膜干燥;(4)切割成所需的形状(如适用)。这种方法可以相对简单地铸造单层和多层薄膜[22]。此外,铸造分散体可以装载微颗粒或纳米颗粒,以便均匀地加入更高剂量的不溶性活性成分[30-31]。在薄膜浇铸过程中必须考虑干燥方式以及干燥温度。尽管在较低温度下较慢地干燥可以获得更好的力学性能,但为了满足大规模工业生产的要求,必须适当优化干燥时间。为了提高药物的稳定性[25]或提高药物的溶出率,研究者们探索了冷冻干燥作为铸造分散干燥的替代方法。据报道,冻干后的样品孔隙率更高,崩解速度更快,力学性能受损对原料药稳定性和溶出速率的影响并不明显[32-34]。 热熔挤出法在生产过程中不需要使用溶剂,主要通过单螺杆或双螺杆挤出机来制备膜剂,将药物与高分子聚合物成膜材料及其他辅料从漏斗加入进料区,送入热熔区后逐渐熔化混匀,利用高温和剪切力使原料药和聚合物熔融共混,熔化的混合物持续通过配量区输出,浇入选定形状的模具,冷却后即形成膜剂。热熔挤出法被认为是口腔膜剂制造的一种新兴技术,作为一种无溶剂的方法,在处理对水敏感的药物时,可能比溶液浇铸法具有优势[35]。 静电纺丝法是一种将带静电的聚合物溶液通过金属针喷射到集热器表面以制备超细纤维的方法。溶剂迅速蒸发导致在收集器上形成无纺布纤维垫。科研人员对聚乙烯醇和聚维酮作为制备静电纺纤维的基体进行了广泛的研究。以这种方式制备的膜的主要优点是高度多孔结构和表面积的增加,与唾液接触后几乎立即崩解和药物快速溶解[36-38]。 研究人员对于使用不同的打印技术作为新型口腔膜剂制造方法的研究兴趣日益增加。2D打印,也称为喷墨打印,是一种非接触的方法,可以将小滴的油墨沉积到合适的承印物上。虽然可以使用不同的衬底,但最常用的是溶剂型薄膜[39]。在这种情况下,薄膜的机械性能尤其重要,因为它需要承受印刷过程中的额外磨损。3D打印是一种增材制造技术,它可以根据预先设计的数字模型,通过连续的材料沉积和熔融来制造三维物理对象。根据目前的数据集,只有基于挤出的3D打印被用于口腔膜剂打印,包括熔融沉积建模(FDM)和半固体挤压(SSE)[40-42]。 1.3 实验设计(DoE)、设计空间和控制策略 DoE是QbD常用工具,用于确定影响研发过程的输入因素(如CMAs、CPPs)和输出因素(如CQAs)之间的关系,最终确定最佳工艺条件和设计空间[4]。DoE一般包括筛选和优化设计。Plackett-Burman设计是常用的筛选设计。响应面法是一种广泛使用的优化方法,包括中心复合设计、Box-Behnken设计等,运用数学模型和统计分析方法,考察各变量或变量之间交互作用对CQAs的影响,从而获得最优条件[43]。 合理的DoE将有效减少实验次数,降低研究成本并确保结果可靠,设计空间内的处方、工艺可最大限度地实现产品所需的CQAs。Sonal Mazumder等[44]采用QbD方法,探索制剂组方和工艺变量对口腔膜剂质量的影响。以拉莫三嗪作为模型药物,采用溶液浇铸法进行制备。制剂组方变量有增塑剂(山梨醇)与成膜剂(预糊化豌豆淀粉)的比例(0.3~0.6)。工艺变量有干燥温度(35~55℃)、干燥室内的空气流速(121~265 CFM)、干燥时间(20~40 min)及薄膜的湿膜厚度(250~350 μm)。用高效液相色谱(HPLC)法测定拉莫三嗪含量和含量均匀性,对拉莫三嗪口腔膜剂进行外观性状、厚度、重量、崩解时限、水分含量和引湿性、溶出速率、机械性能等多方面表征。采用确定性筛选实验设计来识别和归类影响CQAs的组方和工艺变量。此项研究共制备并评估了14种实验室规模的DoE组方,对机械性能(断裂伸长率、屈服应力、杨氏模量、耐折度)及其他CQAs(干燥后厚度、崩解时限、溶出速率、水分、吸湿率、含量和含量均匀度)进行了测定。对实验数据进行多因素分析和方差分析(ANOVA),结果表明,影响机械性能的主要因素是增塑剂与成膜剂的比例及干燥温度;干燥过程中的空气流速及增塑剂与成膜剂的比例对溶出速率影响较大;湿膜厚度和增塑剂比例直接影响干膜厚度,但增塑剂比例升高反而导致干膜变薄,可能与成膜剂的溶胀特性相关;崩解时限和水分含量未受变量的显著影响,含量和含量均匀度均符合要求。为了给配方和工艺变量创建设计空间,SonalMazumder等人对设计空间进行了优化与验证,通过设定 CQAs目标范围(如断裂伸长率10%~20%、溶出时间<6min),验证了优化参数范围:增塑剂比例0.53~0.6、干燥温度37~45℃、湿膜厚度350 μm。在此范围内,口腔膜剂表现出理想的机械性能和快速溶出特性。Rahil Dalal等[45]采用QbD的方法开发和优化了阿塞那平舌下膜,以解决其口服生物利用度低的问题,选用聚环氧乙烷(PEO)和羟丙甲纤维素(HPMC)作为成膜材料。明确舌下膜的剂型、给药途径、剂量等质量目标产品概况要素,确定相关CQAs,通过风险评估识别对CQAs有显著影响的因素。初步试验确定配方组分,用溶液浇铸法制备阿塞那平舌下膜,利用DoE中的单纯形格子设计优化聚合物PEO N10、PEO N80和HPMC E15的配比,评估舌下膜的厚度、重量差异、崩解时限、折叠耐力、拉伸强度等物理和机械性能,初步筛选出3种聚合物的配比,其崩解时限、阿塞那平含量和机械性能均符合要求,差式扫描量热(DSC)分析结果显示药物在膜中以无定形状态存在,与辅料相容性良好。对所制备的舌下膜进行体外释放、离体渗透和体内吸收研究,并开展统计分析,建立线性模型描述聚合物对舌下膜性能的影响,结果显示HPMC浓度主要影响崩解时间,PEO 对折叠耐力和伸长率有积极影响;含高浓度PEO的组方体外释放快,HPMC E15含量增加会降低体外释放速率。体内吸收研究结果显示,以家兔作为实验对象,优化后的舌下膜剂5min内吸收率达(31.18±5.01)%,与市售舌下片(29.97±4.88)%相当,但膜剂具有更快的崩解和释放优势。Dahmash等[46]开发了一种适用于儿童患者的抗癫痫药物托吡酯口溶膜,以解决传统剂型(如片剂或粉末剂)在儿科用药中存在的吞咽困难、剂量灵活性不足等问题。研究使用了溶液浇铸法来制备含有托吡酯的口腔膜剂,通过改变聚合物类型[HPMC、瓜尔胶(GG)或聚乙二醇(PEG)]和浓度(0.4%~1.2%,w/v)、增塑剂类型(甘油或山梨醇)和浓度(0.1%~0.3%,w/v),共制备了24种配方。研究的主要评估指标包括崩解时间、含量均匀度、薄膜质量和厚度均匀度。使用MODDE软件进行D-optimal设计,选择了24个实验,结果表明,口腔膜剂的崩解时间在10~90s,薄膜质量(共包括5项,分别为柔韧性、延展性、不黏附性、剥离度和外观光滑度,每项占比20%)在10%~100%,含量均匀度在82%~108.1%,厚度均匀度在1.03%~9.45%。通过DoE分析,结果显示,不同配方的口腔膜剂在崩解时间、薄膜质量、含量均匀度和厚度均匀度等方面存在差异。模型拟合结果表明,除薄膜质量外,其他响应与所选自变量密切相关。回归模型方程揭示了各因素对响应的影响,如聚合物浓度显著影响崩解时间,HPMC能降低崩解时间,提高含量均匀度和厚度均匀度。通过响应面图确定了最佳配方参数,使用HPMC作为聚合物,浓度在0.83%~1.1%,使用甘油作为增塑剂,浓度在0.11%~0.3%。这些参数能够产生崩解时间小于60s、含量均匀度RSD在±5%以内、厚度均匀度RSD小于2%的口腔膜剂。 综上,实施QbD的目的不仅限于得到某一最佳处方或工艺,关键在于建立一种可以在一定范围内调节偏差以保证产品质量的处方和工艺,即设计空间。在对产品和工艺的理解基础上,建立控制策略,确保生产的产品在设计空间设定的质量标准之内,并进行持续监控和改进,保证产品在生命周期内质量一致。 1.4 过程控制(PAT) PAT也是QbD开发中的一个重要工具。常用的PAT有拉曼光谱、近红外光谱、傅里叶变换红外光谱、荧光光谱和紫外/可见分光光谱等。PAT通过对药物制造和生物加工过程进行实时近线、在线或线内测量,快速、无损地提供化学和物理性质信息,必要时有可能对参数立即进行调整,纠正错误,增强对过程的控制[47]。 由于传统制药生产中的离线检测(如HPLC等)无法实时监控产品的CQAs,PAT通过实时监测可优化生产控制,减少浪费。Florian Hamems等48开发了一种基于反射红外光谱(Reflectance InfraredSpectroscopy)的过程分析方法,用于在线监测口腔膜剂在涂布和干燥过程中活性药物成分尼古丁的CQAs,使用甲基丙烯酸-丙烯酸乙酯共聚物为成膜基质,乙醇-水体系溶解尼古丁,涂布于聚对苯二甲酸乙二醇酯(Polyethylene Terephthalate,PET)基材上。在涂布生产线末端安装反射红外传感器,实时采集干燥后薄膜的光谱数据(光谱范围1600~4100 nm)。采用偏最小二乘法(PLS)建立定量校准模型,评估不同数据预处理方法[如多元散射校正(MSC)、一阶导数等]对模型性能的影响。通过实验室小试,确定尼古丁特征吸收波段(2250~2761 nm),指导生产级数据建模。设置6种涂布间隙,采集30组光谱与HPLC参考值对比,进行实验校准。在独立生产批次中采集24组样本,对比模型预测值与HPLC实测值,进行外部验证。结果显示,尼古丁在2289~2722nm波段表现出显著吸收,与C-H键振动相关,验证了其作为定量分析的依据。其中MSC预处理模型表现最佳,校准标准误差(SEC=0.0172 mg/6.51 cm²)与交叉验证误差(SECV=0.0176mg/6.51 cm²)高度一致(R²=0.984)。外部验证结果显示预测误差(SEP=0.0175mg/6.51cm²),与HPLC结果相关性高(R²=0.981),配对1检验证实预测值与实测值无显著差异(p>0.05)。此项研究显示反射红外光谱技术成功实现了尼古丁口溶膜生产过程中API含量的实时在线监测,模型预测精准可靠,满足PAT框架要求,突破了传统离线检测的局限,支持动态工艺调整,减少材料浪费与批次损失。 《中华人民共和国药典》1985年版即开始收载膜剂各论,1990年版增订了膜剂(Films)通则,并将其定义为药物与适宜的成膜材料经加工制成的膜状制剂,供口服或黏膜用[49]。口腔膜剂最早收载在欧洲药典(EP)口腔黏膜制剂(MucoadhesivePreparations)项下,按照给药途径又分为直接在口中崩解释药的口溶膜(Orodispersible Films)和通过口腔黏膜吸收可避免首过效应的黏附在颊膜和舌下的口颊膜(Buccal Films)[51]。2014年,美国药典(USP)也收载了膜剂,描述为置于口腔内的薄片,可能含有1层或多层,层中可能含有原料药,通常是由聚合物构成的薄膜材料,分为快速释放到口腔的口溶膜(Oral Films)和通过近端黏膜吸收以避免在胃肠道降解或首过效应而快速起效的颊膜(Buccal Films)和舌下膜(SublingualFilms)[51]。2021年,日本药局方(JP)18版增补了口服膜剂(Films for Oral Administration),并在该项下单列了口崩膜(Orally Disintegrating Films)。表5对不同种类口腔膜剂的特性进行了总结[52-53]。目前国内外对口腔膜剂的称谓尚无明确统一的叫法,国外文献中出现过的名称包括“Fast DissolvingFilm”“Oral Strip”“Oral Film”“OrodispersibleFilms”“Wafers”“Buccal Soluble Film”“BuccalFilm”“Oral Thin Film”“Oral Soluble Film”等[29];在我国,对该类产品的名称也是多种多样,国内文献和在研产品中出现的名称有“口溶膜”“口腔贴膜”“口腔速溶膜”“口腔膜”“舌下膜”“口腔贴膜”等。各国药典都对膜剂的质量要求进行了规定。EP要求膜剂应有合适的机械性能,并能以合适的方法测定药物的溶出度;USP要求膜剂应具有合适的溶解速度、合适的强度、适宜的口感和口味;JP要求膜剂的含量均匀度应符合规定,应进行溶出度检查或具有适当的崩解性能。《中华人民共和国药典》2020年版规定膜剂应取20片进行重量差异检查并按照非无菌产品进行微生物限度检查。 ▲表5-不同种类口腔膜剂的特性 目前国外上市多款口腔膜剂,适应证集中在精神、神经、镇痛、男性勃起功能障碍等。FDA批准的口腔膜剂涉及适应证较多,例如精神障碍类有盐酸丁丙诺啡和盐酸纳洛酮的复方舌下膜(Film/Sublingual),镇痛类有枸橼酸芬太尼口腔膜(Film/Buccal)、盐酸丁丙诺啡口腔膜(Film/Buccal)等;欧盟批准上市的多为口溶膜,集中在精神神经领域,活性成分包括利培酮、奥氮平、盐酸多奈哌齐等,如利培酮口溶膜(Orodispersible Film)、盐酸多奈哌齐口溶膜(Orodispersible Film)等[22]。 我国企业在口腔膜剂的布局相对集中,活性成分较为多样。截至2025年2月,国家药品监督管理局官方网站中可以查询到的已批准上市的口溶膜剂包括奥氮平口溶膜、阿立哌唑口溶膜、孟鲁司特钠口溶膜、他达拉非口溶膜、昂丹司琼口溶膜、盐酸美金刚口溶膜。国内已上市及已提出注册申请的精神障碍类治疗药物口溶膜详见表6。 ▲表6-我国已上市或已提出注册申请的部分口腔膜剂 近年来,随着我国药物制剂技术的发展,口腔膜剂相关产品有了较大发展,口腔膜剂具有剂量准确、携带方便、快速溶解等优势,FDA评价其为传统剂型中不可取代的新剂型,已成为多种疾病局部治疗和全身性作用治疗的有效给药方式。2020年11月,国家药品监督管理局批准了我国首个用于精神障碍治疗的改良型新药——奥氮平口溶膜。口腔膜剂开发包括传统方法和基于QbD的优化方法。传统方法需先确定工艺参数的操作范围及设定值,再通过证明工艺的可重复性及检查产品是否符合已确立的标准来控制口腔膜剂的质量;而QbD优化开发方法则更多应用风险管理的科学知识,识别影响CQAs的CMAs和CPPs操作空间,并持续进行全生命周期管理,更有利于生产和监管部门了解产品的生产工艺及相关变更信息。 参考文献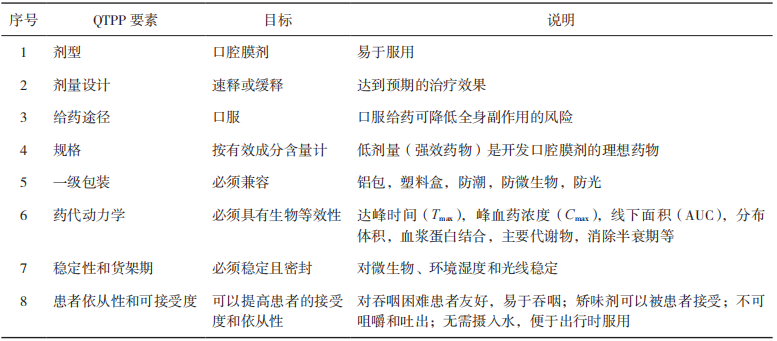





声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容