
2026-01-16 10:02:15来源:药渡浏览量:731
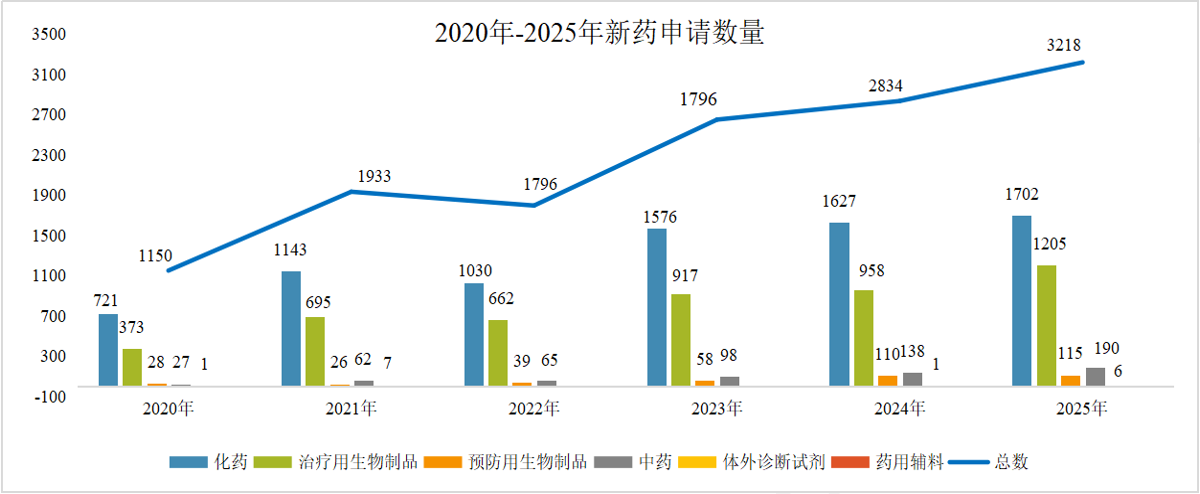
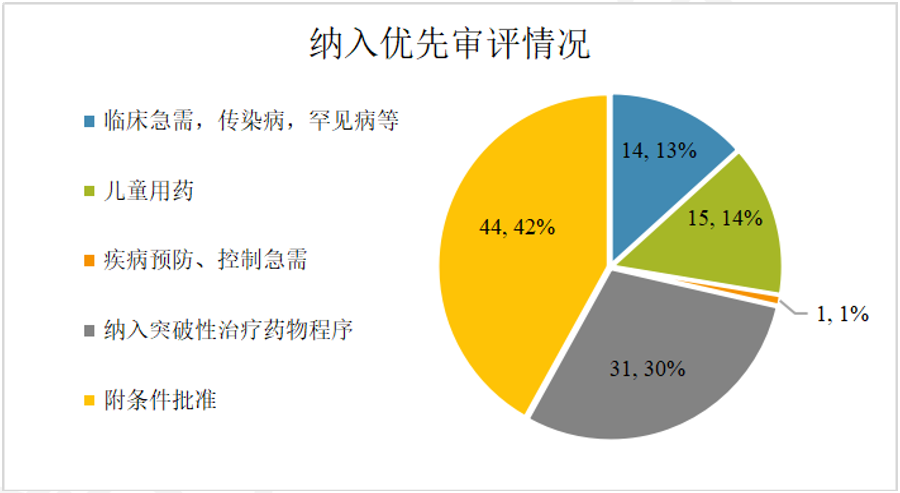
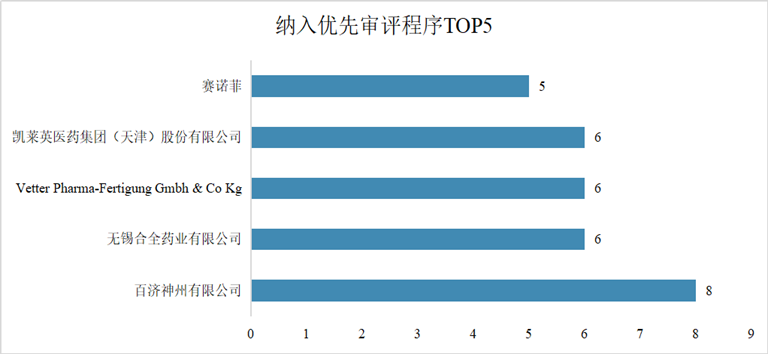
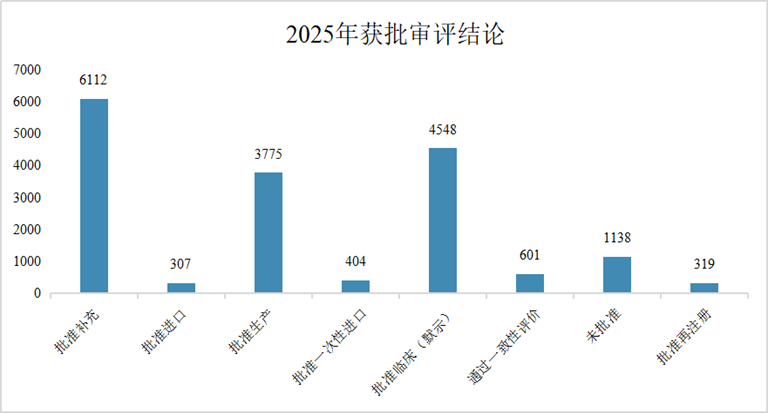
1 药品注册申请受理情况: 总量增长,结构优化 2025年,CDE共承办药品注册申请18434件,延续了近年来的活跃态势。 从构成上看,化学药品注册申请仍为主体,共计11888件,占全部申请量的64.5%;生物制品注册申请3010件,占比16.3%;中药注册申请3516件,占比19.1%。与2024年相比,生物制品和中药的申报数量增幅尤为显著,分别增加了388件和700件,反映出我国在生物医药创新和中药传承发展方面的持续发力。 图2. 2020年-2025年新药申请数量(单位:件) 在创新药申报领域,2025年共受理新药注册申请3218件,其中申请临床2856件,申请上市362件。国产创新药研发热情高涨,药审中心全年受理国产1类新药注册申请2337件,其中化学药1216件,生物制品1004件,中药117件,其适应症主要集中于抗肿瘤、呼吸道及消化系统等重大疾病领域。同时,进口新药及原研药申报也保持稳定,共受理1类进口新药注册申请519件及5.1类化学药进口原研药注册申请104件,为国内患者提供了更多治疗选择。 2 药品注册申请审评审批: 加速通道效能凸显 为鼓励创新、满足临床急需,我国建立了包含优先审评、突破性治疗药物、附条件批准及特别审批在内的药品加快上市注册程序。2025年,这些程序在推动高质量药品上市方面发挥了关键作用。 图3. 纳入优先审评程序的注册申请情况(单位:件) 图4. 纳入优先审评程序TOP5的企业(单位:件) 在优先审评方面,2025年药审中心共将116件注册申请纳入优先审评程序,涉及78个品种。其中,符合“附条件批准”情形的申请占比最高。从企业角度看,一批本土创新药企成为优先审评的“主力军”。 突破性治疗药物程序旨在支持防治严重危及生命疾病且具有显著临床优势的药物研发。2025年,共有89件申请被纳入突破性治疗药物程序,涵盖84个品种,其中生物药占比超过一半,显示出在肿瘤、感染性疾病、自身免疫疾病等复杂疾病领域,生物技术创新正成为突破的关键驱动力。 附条件批准程序为应对重大公共卫生需求或用于严重危及生命疾病的药物提供了早期准入路径。截至统计时点,已累计有127个药品被纳入附条件批准上市程序。该程序基于早期临床数据预测临床价值,在确保风险可控的前提下,显著缩短了药物上市时间,使患者能尽早获益。 图5. 2025年获批结论情况(单位:件) 在药品获批方面,2025年经CDE完成审评并获批的注册申请达17204件。化学药获批数量领先,其中以江苏恒瑞、百济神州、石药集团等为代表的企业在新药获批上表现突出。生物药领域,创新药获批数量显著,涉及肿瘤免疫治疗、代谢性疾病等多个前沿方向。中药获批则以补充申请为主,同时也有多个中药新药获批上市,体现了中药审评审批的稳步推进。 3 年度重点获批新药 研发概述 2025年度,中国国家药品监督管理局批准的多款新药,不仅数量可观,更深层次地映射出我国药物研发向“全球新”与“临床亟需”双轨并进的清晰路径。本年度重点获批新药集中于肿瘤靶向治疗、罕见病、慢性病管理及前沿生物技术领域,展现了从快速跟进到源头创新的能力跃升,并深刻改变了相关疾病的标准治疗格局。 1、在肿瘤治疗领域,精准与后线治疗取得关键进展 百济神州自主研发的BCL-2抑制剂索托克拉片的获批,标志着我国在细胞凋亡通路靶向药研发上达到全球前沿水平。该药物用于既往治疗失败的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤及套细胞淋巴瘤患者,为耐药患者提供了重要的新机制疗法,巩固了我国在血液肿瘤创新领域的领先地位。 诺诚健华的佐来曲替尼片作为新一代高选择性TRK抑制剂,其获批为NTRK基因融合阳性的泛瘤种患者带来了精准治疗选择,体现了“篮子试验”研发模式的成功实践,推动了我国肿瘤诊疗向分子分型驱动的范式转变。 2、在罕见病及专科疾病领域,长期空白被有效填补 上海和誉医药的盐酸匹米替尼胶囊(CSF1R抑制剂)获批用于腱鞘巨细胞瘤,为该良性但极具侵袭性、严重影响功能的肿瘤提供了首个国内获批的靶向治疗药物,解决了手术难以根治患者的临床痛点。 信达生物的匹康奇拜单抗注射液作为国产新型IL-23p19抑制剂,为中重度斑块状银屑病患者提供了高效、便捷的新一代生物制剂选择,展现了国内企业在自免疾病赛道强大的研发转化能力。 3、在慢性病与感染性疾病领域,治疗方案得以优化与升级 健康元引进的玛帕西沙韦胶囊作为一种创新的帽状结构依赖性核酸内切酶抑制剂,为甲流和乙流患者提供了单次口服即可完成疗程的全新作用机制抗病毒药物,提升了用药便捷性与依从性。 正大天晴的库莫西利胶囊作为国产CDK4/6抑制剂,为激素受体阳性、人表皮生长因子受体2阴性的晚期乳腺癌患者提供了重要的内分泌联合治疗基础药物,显著降低了治疗成本,提升了药物可及性。 4、前沿技术疗法的获批标志着审评能力迈上新台阶 例如,芬妥司兰钠注射液作为一款通过附条件批准路径引进的siRNA药物,用于预防血友病患者的出血事件,其作用机制可长效、精准地降低特定凝血因子抑制物,代表了从传统蛋白替代治疗向基因层面干预的跨越。这类药物的成功审评,体现了我国监管体系对于基因沉默等尖端技术药物的评估能力已与国际同步。 综观2025年度的重点新药,其共同特点是“机制新、靶点准、需求切”。它们不仅来自于国内顶尖Biotech的自主研发,也包含通过国际合作快速引入的突破性疗法。这背后,是我国药品审评审批体系,尤其是优先审评、突破性治疗和附条件批准等加速通道高效运行的结果。 4 政策法规体系持续完善 2025年,国家药监局及药审中心发布了多项技术指导原则,进一步规范和引导药物研发与注册。年内发布的指导原则涉及范围广泛,包括《单臂临床试验用于支持抗肿瘤药物常规上市申请技术指导原则》、《重组腺相关病毒载体类体内基因治疗产品申报上市药学共性问题与技术要求》、《创新药研发期间风险管理计划撰写技术指导原则》等。 这些指导原则不仅关注前沿技术领域如基因治疗、ADC药物,也细化了针对老年人群、儿童用药等特殊群体的研发要求,并持续优化仿制药、中药的申报技术要求,标志着我国药品监管科学体系正向更精准、更系统、更国际化的方向迈进。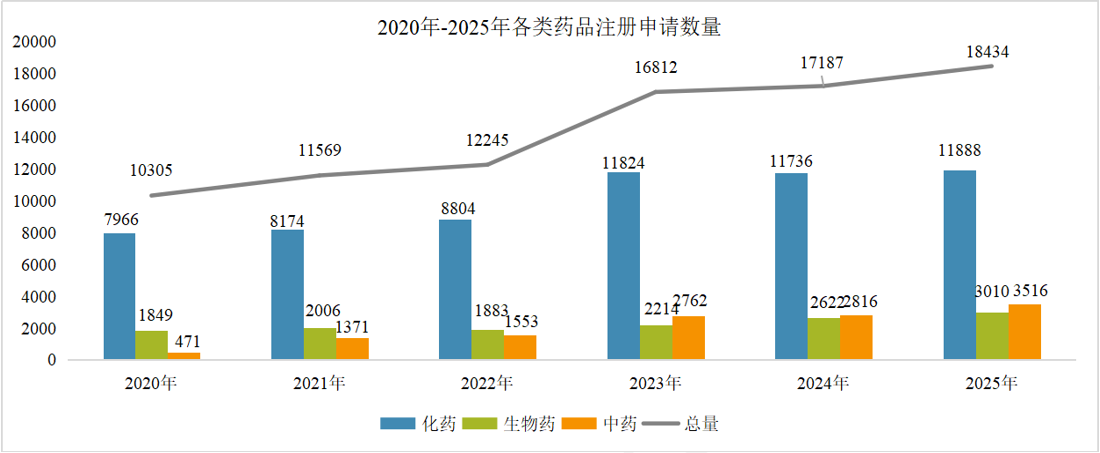
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容