
2023-01-10 11:07:06来源:药智头条浏览量:665
导读:谨慎乐观期待Lecanemab
近日,美国FDA宣布加速批准了卫材/Biogen的阿尔茨海默病新药Lecanemab,商品名为Leqembi。
该药是一种抗β淀粉样蛋白(Aβ)抗体,能与可溶性Aβ聚合体结合,并且促进它们的清除。新英格兰医学期刊在不久前才正式发表该药的三期临床试验结果:在18个月时,Lecanemab减少了早期阿兹海默症中淀粉样蛋白的标记物,并且导致认知和功能指标的下降程度低于安慰剂,但与不良事件有关。
图片来源:卫材官网
100多年前德国精神病学家阿尔茨海默首次将一例痴呆症与大脑中的异常沉积物联系起来。研究人员基于这样一个论点,即治疗阿尔兹海默病需要清除这些大脑异常斑块,这些异常斑块由淀粉样蛋白组成,会阻塞患者的大脑。
靶向淀粉样蛋白的药物在不断的失败之后(包括 2021年FDA批准的一款有争议的药物Aduhelm),名为仑卡奈单抗(lecanemab)的药物在2022年底报告的一项大型三期临床试验中成为第一个明确减缓阿尔茨海默病进展的药物,给阿尔茨海默新药研发领域带来了希望。
但同时,该药也依然有很多局限性,例如特定人群使用后可能出现“严重副作用”。包括有3名患者在实验期间出现脑出血症状,不幸死亡。
为何国内外获批的AD药物争议不断?
这几年国内外治疗阿尔兹海默症的药物新闻可以发现争议不断。
2019年11月我国药品监督管理局有条件批准绿谷制药的褐藻提取物为原料制备寡糖化合物甘露特钠(GV-971)上市,据研究报道GV-971的机理是靶向脑-肠轴,并通过调节肠道菌群的失衡和减少神经炎症来提高认知能力。目前该药盒每296元;按每月4盒计算,患者用药费用约每月1184元,平均患者每日费用接近40元。但不少业内专家对GV-971提出质疑,疑问包括GV-971的3期临床试验周期过短、效果评估依据不充分、药物作用机理阐释不明、试验只有一项等方面。甚至不少有医学背景的网友在知乎设置议题“如何看待GV-971进入医保及国际3期临床试验停止,该药科学性如何”,并就GV-971疗效问题发出质疑。
而随后2021年6月,美国FDA批准了单抗药物Aduhelm。这也是来自渤健和卫材的阿尔茨海默病治疗药物。尽管试验结果相互矛盾:一项大型临床研究表明无效,而另一项研究表明在减缓认知能力下降方面有一点好处;这两项试验都被渤健提前终止,导致结果难以解释。美国FDA不顾外部医学专家小组的建议批准了该药物。随后该小组的三名成员随后辞职,雪上加霜的是美国医保机构严格限制了Aduhelm的报销。导致该药物最终停止在美国销售。美国国会调查人员在12月得出结论,Aduhelm的批准过程“充斥着违规行为”称FDA在评估该药物时与制药商过度合作。
这一次,仑卡奈单抗有哪些不同?
仑卡奈单抗是由日本卫材和美国渤键联合开发的单克隆抗体药物。用于针对特定的淀粉样蛋白,这种蛋白与早发遗传性阿尔茨海默氏症的瑞典家庭有关。
在一项包含1800名早期阿尔茨海默病患者的为期18个月的临床试验中,接受仑卡奈单抗治疗的患者脑淀粉样蛋白水平显著降低。更重要的是,与接受安慰剂的一组相比,该药物使他们的认知和功能下降速度减慢了27%。与服用安慰剂的对照组相比服用此药的阿尔茨海默氏患者的认知能力下降有所减缓。
行为神经学家科恩(Sharon Cohen) 博士评价道:“总体来说仑卡奈单抗在很多方面都超出了预期,因为直到现在我们还没有在阿尔茨海默病临床试验中看到如此一致的积极结果。”
本次lecanemab在美国获批,代表在阿尔茨海默病治疗领域的又一项重要进展。
在中国,2022年12月22日,仑卡奈单抗(lecanemab)注射液的上市申请获国家药监局受理,适应症为轻度阿尔茨海默病(AD)和阿尔茨海默病引起的轻度认知障碍疾病的改善治疗。
仑卡奈单抗适合哪些人群?
该药已在早期阿尔兹海默患者中进行了测试,症状包括衰老引起的轻度健忘,注意力不集中,轻度认知障碍和轻度痴呆症患者。
为获得该药物的临床试验资格,志愿者可能需要接受脑淀粉样蛋白的检测,超过三分之二的阿尔茨海默病患者和上千万患有轻度认知障碍的患者中约有一半存在脑淀粉样蛋白的迹象。脑淀粉样蛋白PET扫描的费用可能高达7千美元。另外脊椎穿刺也是另一种检测方法,但这种检查有侵入性,有时还会引起疼痛,因此一些患者会回避。除此之外美国和日本有一些血液测试可以判断大脑中是否存在淀粉样蛋白,但这种检测尚未通过FDA批准。不过2021年12月,日本卫生部批准了由Sysmex Corp和卫材开发的此类测试。
仑卡奈单抗有哪些局限?
在临床试验中观察到的认知衰退减缓是显著但微小的,并且该药物不会阻止疾病进展。
但此药的效果也伴随着副作用。超过五分之一的服药患者出现脑肿胀或出血。其余患者没有上述症状,但有时会出现头痛、视力障碍和意识模糊。值得重视的是有五人出现大面积脑出血。三位服用抗凝血药物的患者在试验临床试验期间死亡。刊登在新英格兰杂志的论文显示死亡可能和同时服用抗凝血药物有关。
另外,卫材表示,Leqembi在美国市场的定价为2.65万美元/年,并不便宜。
这一靶点的竞争对手有哪些?
即将获得批准的主要潜在竞争对手是礼来公司的多纳单抗(donanemab)。
在2021年报告的一项临床2期试验中,多纳单抗显著降低了早期阿尔茨海默病患者的大脑淀粉样蛋白,并将认知和功能衰退减缓了32%。该公司已在美国申请基于降低淀粉样蛋白的新药加速审批。目前正在进行更大规模的临床3期试验,应该会在近期报告结果。积极结果可能会加速此药的获批上市。
另外罗氏的另一种降低淀粉样蛋白的单抗药物甘特纳姆单抗(gantenerumab)在旧金山举行的第 15 届阿尔茨海默病临床试验会议上宣告两项大型临床试验失败,药物未能减缓认知能力下降。科学家们表示,仑卡奈单抗的成功和甘特纳姆单抗的失败。同时证明了一个观点:即淀粉状斑块需要被完全清除,然后大脑才能缓慢地做出反应。
小结
阿尔茨海默病堪称药物研发的无底洞。据药智网报道近十年来药厂针对阿尔兹海默症累计投入的研发费用已超6000亿美金。文献调查显示95年以来临床阶段研发费用约为425亿美元,至今已有18万4千名患者已注册或正在参加临床试验。
但实事求是地看,包括已上市的药物在内也只能减缓疾病进程。至今该疾病仍然无法治愈,发病机制除了主流的淀粉样蛋白逐渐沉积和细胞内Tau蛋白聚集导致的神经元死亡和认知障碍,还包括多重其他假说致病机理仍无法明确。
据统计全球患者已超过5000万人,预计2050年将突破1.52亿人。其中65岁以上患者将达到1380万人。当前中国有1507万60岁及以上的痴呆患者,其中983万人患有阿尔兹海默症,392万人患有血管性痴呆。132万人患有其他形式的痴呆。我国是新发病例全球增速最快的国家之一。如此巨大的高度未满足的临床需求使得该领域依然挑战与机会并存,数AD药物,还看今朝。
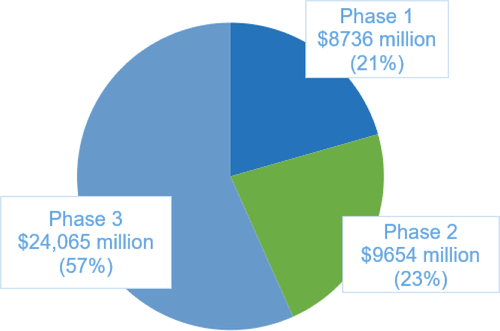
图1 从1995年至2021年按临床试验阶段划分的药物开发成本。图源:参考资料1
参考资料:
1.开发阿尔茨海默病治疗方法的成本https://alz-journals.onlinelibrary.wiley.com/doi/full/10.1002/alz.12450
2.临床成功≠商业化成功?卫材/渤健寻求CMS“网开一面” https://news1.yaozh.com/archive/37652.html
3.阿尔茨海默新药971的争议 https://m.huxiu.com/article/478852.html
4.阿尔茨海默药物有助于控制症状https://www.mayoclinic.org/zh-hans/diseases-conditions/alzheimers-disease/in-depth/alzheimers/art-20048103
5.阿尔茨海默症“神药”安全性再度遭疑https://k.sina.com.cn/article_2094942911_7cde4abf019017ljy.html?from=health#/
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容