
2023-05-06 15:02:17来源:医药地理PRO浏览量:1213
4月24日,兴齐眼药发布公告称,国家药品监督管理局已受理其硫酸阿托品滴眼液上市申请。此前,尚无硫酸阿托品滴眼液获批上市。
本次上市申请被受理的是0.01%硫酸阿托品滴眼液延缓儿童近视进展的三期临床试验,该研究是一项随机、双盲、安慰剂平行对照、多中心临床试验,406例6至12岁儿童受试者经过了为期1年的用药观察,停药后0.5年的随访观察,评估硫酸阿托品滴眼液延缓儿童近视进展的有效性和安全性。
结果显示,硫酸阿托品滴眼液组对比安慰剂组在主要疗效指标上有统计学意义的显著性差异,硫酸阿托品滴眼液组优于安慰剂组,安全性良好,患者使用依从性好。
临床数据能否站得住脚?
今年2月,医学杂志JAMA的一项研究论文指出,在4至9岁无近视的儿童中浓度0.01%的阿托品与安慰剂降低近视发生率的比较差异无统计学意义。
由此可见,虽然阿托品有潜在预防近视的可能,但其作用机制尚不明确,且未有大规模临床数据证明其疗效。
国内阿托品滴眼液市场格局
目前,国内的阿托品滴眼液大多以院内制剂的形式销售。与常规上市的药物相比,院内制剂不需要经过严格的临床验证,也不需要药监局审核,只需由医疗机构提出申请,由省、自治区、直辖市药监局批准。
中国医药工业信息中心CPM新药研发监测数据库显示,国内布局硫酸阿托品滴眼液临床试验的公司共12家,具体申报情况如下图所示。
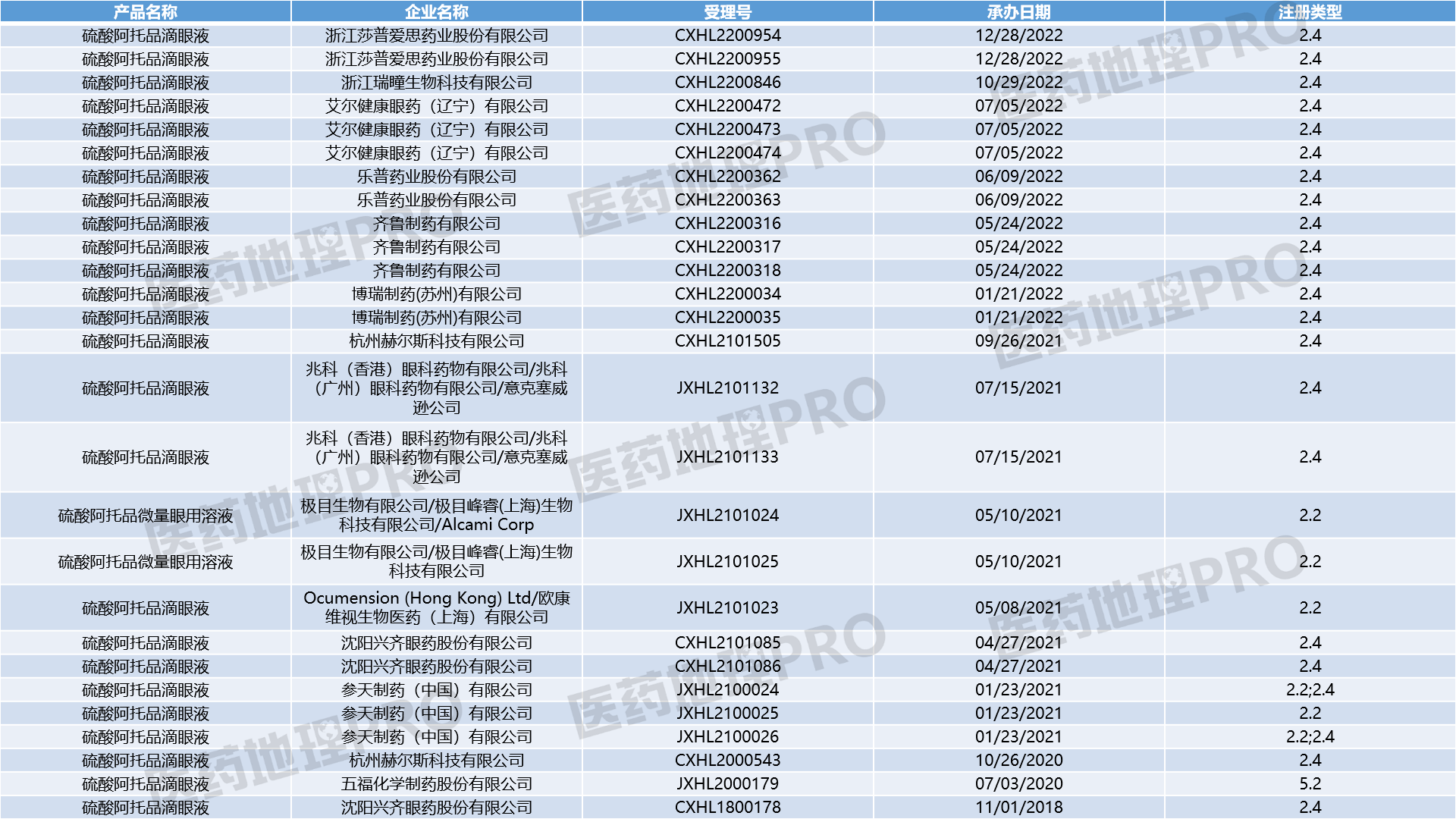
据兴齐眼药2022年年报,目前公司共有三个处于不同临床试验阶段的阿托品滴眼液临床项目,分别为0.01%浓度、0.01%浓度和0.02%浓度及0.04%浓度,适应症均为延缓儿童近视进展。
文章版权归原作者所有。如涉及作品内容、版权和其它问题,请跟我们联系删除!文章内容为作者个人观点,并不代表本平台赞同或支持其观点。本平台拥有对此声明的最终解释权。