
2023-05-06 16:24:10来源:医药地理浏览量:1480
政策解读
1. 国家药监局:关于改革完善放射性药品审评审批管理体系的意见
2. 国家药监局药审中心连续发布3条公告
3. 国家药监局关于修订13种药品说明书的公告
4. 国家药监局:关于地氯雷他定分散片等4种处方药转换为非处方药的公告
5. 国家药监局:适用《E19:在特定的上市前后期或上市后临床试验中选择性收集安全性数据》国际人用药品注册技术协调会指导原则
6. 国家儿童肿瘤监测中心编制的《国家儿童肿瘤监测年报(2022)》已发布
7. 湖北省药品监督管理局集中约谈部分药品零售连锁企业
8. 河北省药品监督管理局:2023年化药第9号药品GMP符合性检查结果通告
行业动态
1. 药讯动态:重磅获批和重磅临床
2. 药企动态:市场动态
零售品类数据洞见
1. 氧氟沙星零售样本市场销售分析
2. 氧氟沙星零售放大市场销售分析

政策解读
1、国家药监局:关于改革完善放射性药品审评审批管理体系的意见
4月25日,国家药监局发布《国家药监局关于改革完善放射性药品审评审批管理体系的意见》。《意见》指出,放射性药品在恶性肿瘤、心脑血管疾病、中枢神经系统疾病等诊断与治疗方面具有特殊重要作用,主要包括放射性核素制剂、核素标记药物等。结合药品监管工作实际,提出多项改革意见。
《意见》提出,鼓励药品研发,满足临床急需。鼓励以临床价值为导向的放射性药品创新,鼓励境外已上市原研放射性药品在我国境内进口注册。对临床急需的放射性药品上市许可申请给予优先审评审批,建立早期介入、持续跟踪、主动服务、研审联动的长效机制,加强研发申报全过程的沟通指导。加强与卫生健康主管部门沟通协作,将临床急需的境外已上市、境内未上市放射性药品纳入鼓励仿制药品目录,引导企业研发。
2、国家药监局药审中心连续发布3条公告
4月26-27日,CDE连续发布3条公告。
为指导和规范肿瘤主动免疫治疗产品临床试验,提供可参考的技术规范;为指导慢性乙型肝炎病毒感染治疗药物的科学研发和评价,提供可供参考的技术标准,在国家药品监督管理局的部署下,药审中心组织制定了《肿瘤主动免疫治疗产品临床试验技术指导原则(试行)》、《慢性乙型肝炎病毒感染治疗药物临床试验技术指导原则》和《人源干细胞产品药学研究与评价技术指导原则(试行)》。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。

详情请扫描上方二维码
查看原文件
3、国家药监局关于修订13种药品说明书的公告
4月24-26日,国家药监局发布了相关药品修订说明书的12条公告。根据药品不良反应监测和安全性评价结果,为进一步保障公众用药安全,国家药品监督管理局决定对金乌骨通胶囊、白芍总苷胶囊、环磷腺苷注射剂、托法替布制剂、二氯醋酸二异丙胺注射剂(含复方二氯醋酸二异丙胺)、壮骨止痛胶囊、小儿咳喘灵制剂、吡拉西坦制剂、泛影葡胺注射液等含碘对比剂、全身用利巴韦林制剂、注射用人白介素-11、乙酰谷酰胺注射剂、三磷酸腺苷二钠制剂说明书项进行统一修订。之后分别对上述药品的上市许可持有人、 临床医师、药师、患者及省级药品监督管理部门做出了相关要求。

4、国家药监局:关于地氯雷他定分散片等4种处方药转换为非处方药的公告
4月28日,根据《处方药与非处方药分类管理办法(试行)》(原国家药品监督管理局令第10号)的规定,经国家药品监督管理局组织论证和审核,地氯雷他定分散片、氯雷他定颗粒、盐酸氨溴索口腔崩解片、萘普生钠片由处方药转换为非处方药。品种名单及其非处方药说明书范本一并发布。
请相关药品上市许可持有人在2024年1月22日前,依据《药品注册管理办法》等有关规定,向省级药品监督管理部门提交修订说明书备案,并将说明书修订内容及时通知相关医疗机构、药品经营企业等单位。
非处方药说明书范本规定内容之外的说明书其他内容按原批准证明文件执行。药品标签涉及相关内容的,应当一并修订。药品上市许可持有人提交备案之日起生产的药品,不得继续使用原药品说明书。
5、国家药监局:适用《E19:在特定的上市前后期或上市后临床试验中选择性收集安全性数据》国际人用药品注册技术协调会指导原则
4月24日,为推动药品注册技术标准与国际接轨,经研究,国家药品监督管理局决定适用《E19:在特定的上市前后期或上市后临床试验中选择性收集安全性数据》国际人用药品注册技术协调会指导原则。现就有关事项公告如下:
一、自2023年10月21日起,启动的药物临床试验相关要求适用《E19:在特定的上市前后期或上市后临床试验中选择性收集安全性数据》。
二、相关技术指导原则可在国家药品监督管理局药品审评中心网站查询。国家药品监督管理局药品审评中心负责做好本公告实施过程中的相关技术指导工作。
6、国家儿童肿瘤监测中心编制的《国家儿童肿瘤监测年报(2022)》已发布
4月22日,在武汉召开的第二届国家卫生健康委儿童血液病、恶性肿瘤专家委员会暨国家儿童肿瘤监测报告会暨儿科抗肿瘤药物临床应用与管理大会上,《国家儿童肿瘤监测年报(2022)》正式发布,首次展示了我国不同癌种、性别、年龄组的儿童肿瘤发病率的估算结果。据结果显示,我国2019-2020年儿童肿瘤平均发病率为125.72/百万,白血病、中枢神经系统肿瘤、淋巴瘤排名前三位。《国家儿童肿瘤监测年报》每隔两年发布一期,2021年3月首次发布,本次发布的《国家儿童肿瘤监测年报(2022)》共收录了2019-2020年间来自31个省(自治区、直辖市)及新疆生产建设兵团的376家儿童肿瘤监测点的登记资料,监测对象为0~19周岁的肿瘤出院患儿。

7、湖北省药品监督管理局集中约谈部分药品零售连锁企业
4月25日,针对监督检查发现的问题,湖北省药监局召开药品安全责任约谈会,集中约谈8家药品零售连锁企业负责人和质量负责人。省局党组成员、副局长贡勇斌同志出席会议并讲话。他指出,药品安全关乎人民群众身体健康和生命安全,是重大的政治问题、经济问题和民生问题。要以对人民群众高度负责的精神,牢固树立安全意识、质量意识、责任意识、风险意识、法治意识,正确处理好发展和安全、质量和效益、责任和义务、公众利益和商业利益、道德和法律、诚信和法治、自律和他律的关系,不断强化落实企业主体责任和部门监管责任,共同守护药品质量安全,促进医药产业高质量发展。他要求被约谈企业坚持问题导向,对标对表,深查实改,不断完善药品经营质量管理体系,提高质量管理水平,规范经营行为,确保企业处于合规状态。被约谈企业负责人纷纷表示,要认真落实约谈会要求,全面加强质量管理,严格遵守法律法规,迅速采取有力措施,深入排查,全面整改,确保药品经营持续合规,保障人民群众用药安全、有效、方便、及时。
8、河北省药品监督管理局:2023年化药第9号药品GMP符合性检查结果通告
4月25日,按照《药品管理法》、《国家药监局关于实施新修订<药品生产监督管理办法>有关事项的公告》(2020年第47号)要求,经现场检查和综合评定,石药集团欧意药业有限公司等五家企业通过《药品生产质量管理规范(2010年修订)》符合性检查。


1、药讯动态:重磅获批和重磅临床
最近重磅获批
1. 优时比研发用于适合系统治疗的成人中重度斑块状银屑病的人源化单克隆IgG1抗体比吉利珠单抗注射液(bimekizumab)已获国家药监局药审中心(CDE)批准上市。
2. 亿帆医药收到国家药监局签发的用于急性骨骼肌疼痛相关不适症状的辅助治疗的美索巴莫注射液上市许可申请《受理通知书》。
3. 渤健/lonis联合宣布FDA已同意加速批准用于治疗超氧化物歧化酶1 (SOD1)突变所致的肌萎缩侧索硬化(ALS)患者的反义寡核苷酸疗法Tofersen上市。
4. 恒瑞医药子公司瑞石生物开发的用于治疗非囊性纤维化支气管扩张症的1类化药RSS0343片获国家药监局(NMPA)临床默示许可。
5. 兴齐眼药的用于延缓儿童近视的2.4 类化药硫酸阿托品滴眼液上市申请获国家药监局受理。
6. 君实生物在研用于治疗高胆固醇血症的重组人源化抗 PCSK9 单克隆抗体注射液(JS002/昂戈瑞西单抗)已获国家药监局药审中心(CDE)批准上市。
最近重磅临床
1. 荣昌生物制药(烟台)股份有限公司自主研发的创新型抗体偶联药物(ADC)注射用RC108联合伏美替尼或联合伏美替尼和特瑞普利单抗的Ⅰb/Ⅱ期临床研究正式获得国家药监局药审中心(CDE)批准。
2. 泽璟制药用于晚期实体肿瘤的治疗的1类生物制品注射用ZGGS15获国家药监局(NMPA)临床试验默示许可。
3. 信诺维研发的创新型抗体偶联药物(ADC)XNW27011的1期/2期临床试验申请获得国家药监局药审中心(CDE)批准,该产品用于治疗Claudin 18.2(CLDN18.2)表达的局部晚期不可切除或转移性恶性实体瘤患者。
4. 百利天恒宣布其自研1类生物制品注射用BL-M11D1(CD33-ADC)获国家药监局临床默示许可,即将开展用于复发或难治性急性髓系白血病患者的I期临床试验。
5. 恒瑞医药子公司瑞石生物开发的用于治疗非囊性纤维化支气管扩张症的1类化药RSS0343片获国家药监局(NMPA)临床默示许可。
2、药企动态:市场动态
1. 4月23日,荣灿生物医药技术(上海)有限公司(荣灿生物)与国药集团中国生物上海生物制品研究所有限责任公司(上海生物制品研究所)签署合作协议,双方将充分利用各自资源与优势,合作打造自主可控的mRNA疫苗(药物)研发技术平台,并基于该平台研发多款mRNA疫苗(药物)。
2. 4月23日,远大医药发布公告称,已于近日签订股权收购协议,以不超过3750万美元从BlackSwan Vascular原股东收购该公司的87.5%股权。待交易完成后,BlackSwan公司将会成为远大医药非全资拥有附属公司。
3. 4月24日,礼来宣布已将高血糖素鼻用粉雾剂(Baqsimi)的全球权益出售给Amphastar。根据协议,Amphastar将在交易完成时支付5亿美元现金给礼来,交易完成一周年时再支付1.25亿美金。此外,礼来也有资格获得总金额高达4.5亿美元的销售里程金。该协议预计2023年第二季度或第三季度完成。

零售品类数据洞见
1、氧氟沙星零售样本市场销售分析
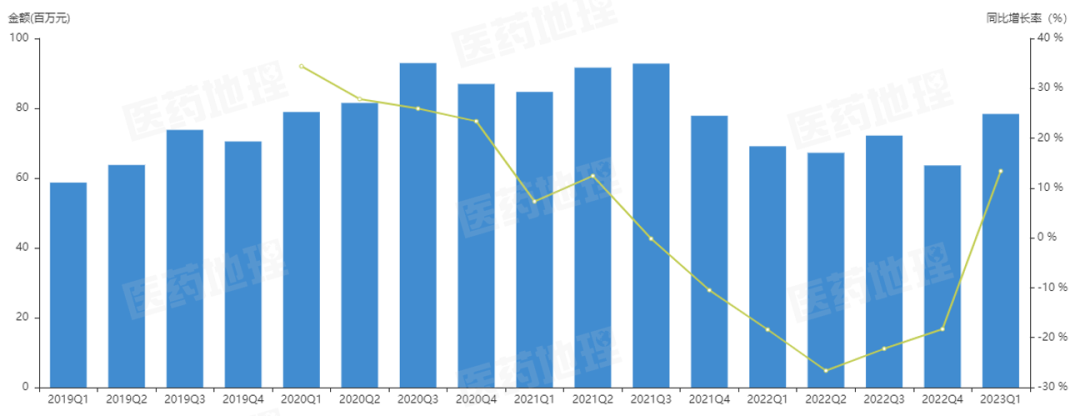
图1:氧氟沙星零售(样本市场)销售额

图2: 氧氟沙星零售(样本市场)企业销售额
*数据来源:中国医药工业信息中心
中国药品零售数据库RPDB 样本药店数据
2、氧氟沙星零售放大市场销售分析
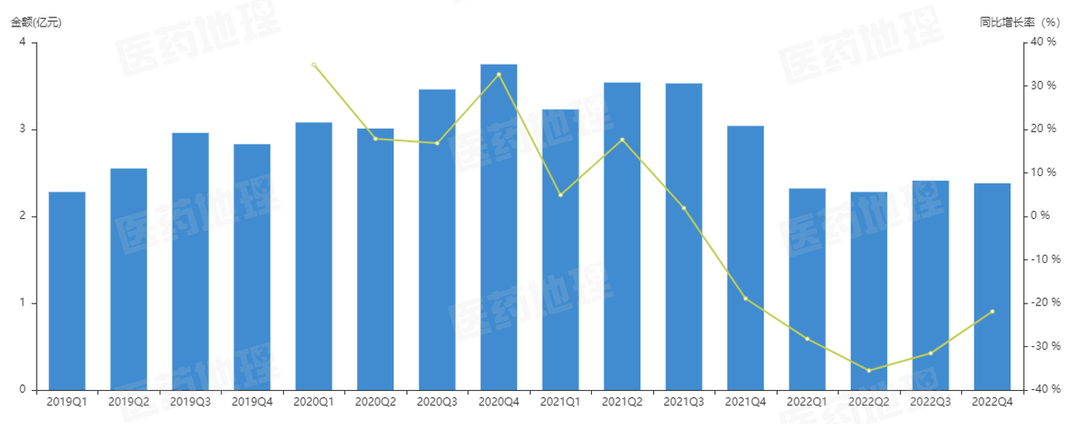
图3: 氧氟沙星零售(放大市场)销售额
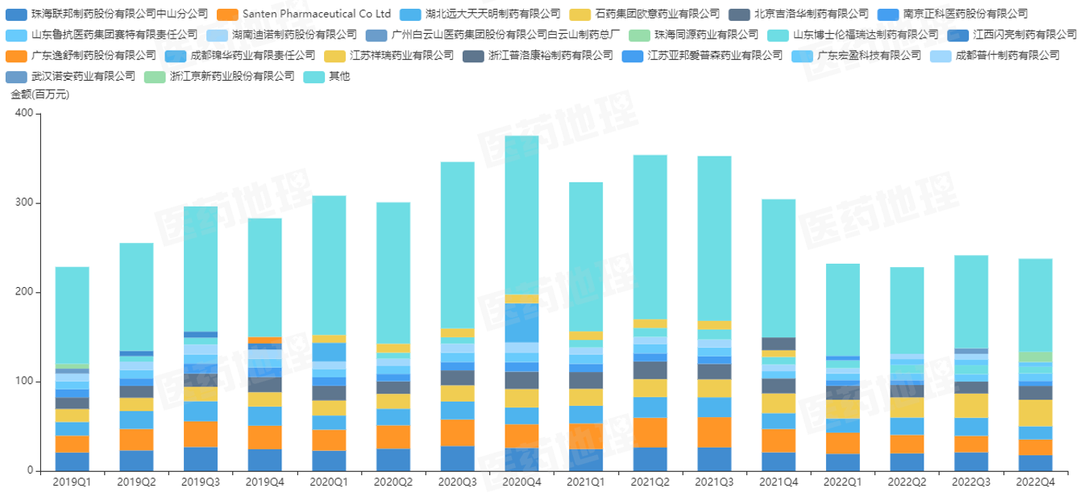
图4: 氧氟沙星零售(放大市场)企业销售分析
*数据来源:中国医药工业信息中心
中国药品零售数据库RPDB 样本药店数据