CardiAMP治疗心力衰竭的III期试验中期疗效未能达到主要终点

9月5日, BioCardia宣布根据初步数据,其用于心力衰竭的临床阶段实验性细胞疗法CardiAMP不太可能达到其主要终点。
数据安全监测委员会(DSMB)按照Finkelstein-Schoenfeld方法,基于12个月的数据,对全因死亡率、非致死性主要不良心脏事件和6分钟步行测试进行了分级评估。结果显示以上三个方面都无统计学显著性差异。但对患者长达24个月的随访显示,治疗组中全因死亡的发生率为8.3%,而对照组为13.2%(p=0.94)。非致死性主要不良心脏事件也有一定差异,治疗组的发生率为16.7%,而对照组为23.6%。
实际上,这一临床失败早已显现端倪。7月24日,BioCardia 宣布,美国数据和安全监测委员会(DSMB)建议暂停其“CardiAMP细胞疗法”治疗心力衰竭的3期试验招募,因为初步数据分析表明该产品不太可能达到主要终点。

9月11日,诺华宣布终止GT005(PPY988)在干性老年性黄斑变性(dry-AMD)继发性地理萎缩(GA)中的开发。该项目是诺华在2022年以8亿美元的预付款,7亿美元的潜在里程碑付款,总计15亿美元重资购入。
这一终止决定是基于数据监测委员会(DMC)的建议,委员会分析数据认为,该产品的II期试验的总体效益风险评估不支持进一步开发,已达到无效标准。
早前,该产品一度展现出良好的疗效,据2021年初公布的GT005的1/2期临床试验积极的中期数据显示,GT005基因治疗耐受性良好,并能提高大多数患者的CFI水平。
IL-17类抗体Izokibep治疗化脓性汗腺炎
2b/3期临床未达到主要终点

9月11日,ACELYRIN, INC公布了评估 izokibep治疗中度至重度化脓性汗腺炎(HS)的2b/3期试验的 B部分的主要结果,结果显示,39%每周接受izokibep治疗的患者在第16周达到HiSCR75,每两周接受izokibep治疗组中这一比例为34%,安慰剂组为29%,没有实现统计学意义上的改善。
尽管如此,ACELYRIN认为izokibep显示出了早期的HiSCR100应答,药代动力学暴露和HiSCR应答都支持明确的剂量效应,即每周用药160mg,而且没有证据表明安全性或耐受性受到限制。
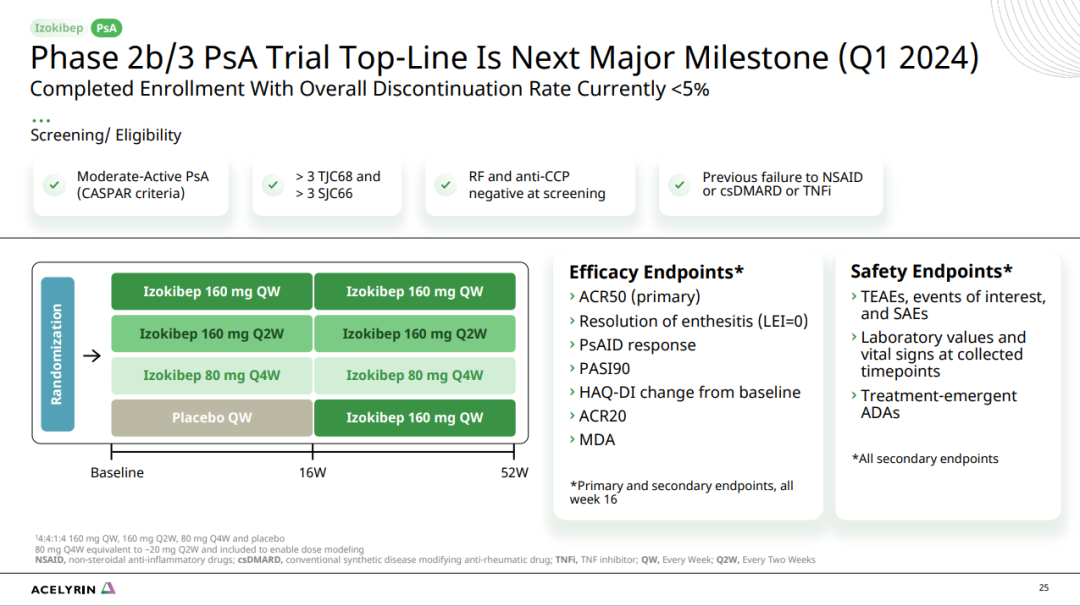
并且Izokibep还在探索银屑病关节炎等适应症,预计2024年一季度获得银屑病关节炎2b/3期临床顶线数据。
终止聚乙二醇干扰素lambda在慢性丁型肝炎(CHD)患者
中的3期LIMT-2研究

9月12日,Eiger BioPharmaceuticals宣布终止聚乙二醇干扰素lambda在慢性丁型肝炎(CHD)患者中的3期LIMT-2研究。该决定是基于数据安全监测委员会(DSMB)在季度安全审查后对该研究的建议。原因是观察到四名患者出现肝胆事件,导致肝脏失代偿。
该项3期LIMT-2研究是一项完全公开、平行对照的临床试验,它将得到良好治疗的冠心病患者随机分为两组:聚乙二醇干扰素λ 180 mcg每周一次,治疗48周,随访24周(治疗组1,人数=105),或不治疗12周,然后聚乙二醇干扰素λ治疗48周,随访24周(治疗组2,人数=53)。今年7月,该试验完成了对来自12个国家48个研究地点的158名患者的登记。
受到研发终止利空影响,公司股价盘前大跌超过50%,市值仅剩0.15亿美元。2023年中报显示,公司营收851万美元,研发费用支出3614万美元,净利润亏损4347万美元,在手现金及等价物2300万美元。

9月19日,Taysha Gene Therapies宣布,在收到美国FDA在C类会议上关于TSHA - 120注册路径的反馈意见之后,将停止其TSHA-120项目的开发,该项目用于治疗巨轴索神经病( GAN )。Taysha表示FDA于去年年底要求其进行安慰剂随机对照试验,taysha近期提交了补充临床数据作为回应,但未能说服FDA放弃该提议,继续推荐随机、双盲、安慰剂对照试验作为证明TSHA-120疗效的最佳途径。由于研究设计可行性方面存在挑战,因此其决定停止该项目的进一步开发。
GAN是一种罕见且严重的常染色体隐性神经退行性疾病,主要是由于巨轴突蛋白功能丧失、巨轴突蛋白基因致病突变导致疾病的发生。目前,尚无批准上市的GAN疗法。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容
