一、视频回放│药审中心举办2024年第八期“药审云课堂”
网址:https://www.cde.org.cn/main/news/viewInfoCommon/5ea44d6d2a17494dfb20acdccfaa1c46

2024年8月2日,药审中心举办了第八期“药审云课堂”,就新发布的有关文件进行宣贯,并对抗肿瘤药物研发、创新药临床研究、ICH相关指导原则等进行了解读。来自药品监管机构、药品研发生产企业、研究机构、医疗机构及高等院校等8000余人在线观看。
本次培训,来自药审中心不同业务部门的7位讲者重点围绕电子申报资料网络传输介绍、抗肿瘤药物临床审评中的共性问题、创新药审评中临床药理常见问题和考虑、治疗性蛋白药物药代动力学研究常见问题和考虑、ICH S6生物制品的临床前安全性评价、先进治疗产品审评共性问题等进行了解读分享。
现将本场培训视频链接和二维码在我中心网站发布,以供交流分享,播放时间截至8月30日。
培训视频观看链接:
https://wx.vzan.com/live/page/1732713776?v=1721981708036
培训视频观看二维码:
一、2024年08月13日中药品种保护受理公示
https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20240813155943197.html
二、国家药监局关于参苏感冒片等4种处方药转换为非处方药的公告(2024年第101号)https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20240815150657149.html根据《处方药与非处方药分类管理办法(试行)》(原国家药品监督管理局令第10号)规定,经国家药品监督管理局组织论证和审核,参苏感冒片、复方川贝精颗粒、复方太子参颗粒、复方石韦咀嚼片由处方药转换为非处方药。品种名单(附件1)及非处方药说明书范本(附件2)一并发布。
请相关药品上市许可持有人于2025年5月11日前,依据《药品注册管理办法》(国家市场监督管理总局令第27号)等有关规定,就修订说明书事项向省级药品监督管理部门备案,并将说明书修订的内容及时通知相关医疗机构、药品经营企业等单位。非处方药说明书范本规定内容之外的说明书其他内容,按原批准证明文件执行。药品标签涉及相关内容的,应当一并修订。自补充申请备案之日起生产的药品,不得继续使用原药品说明书。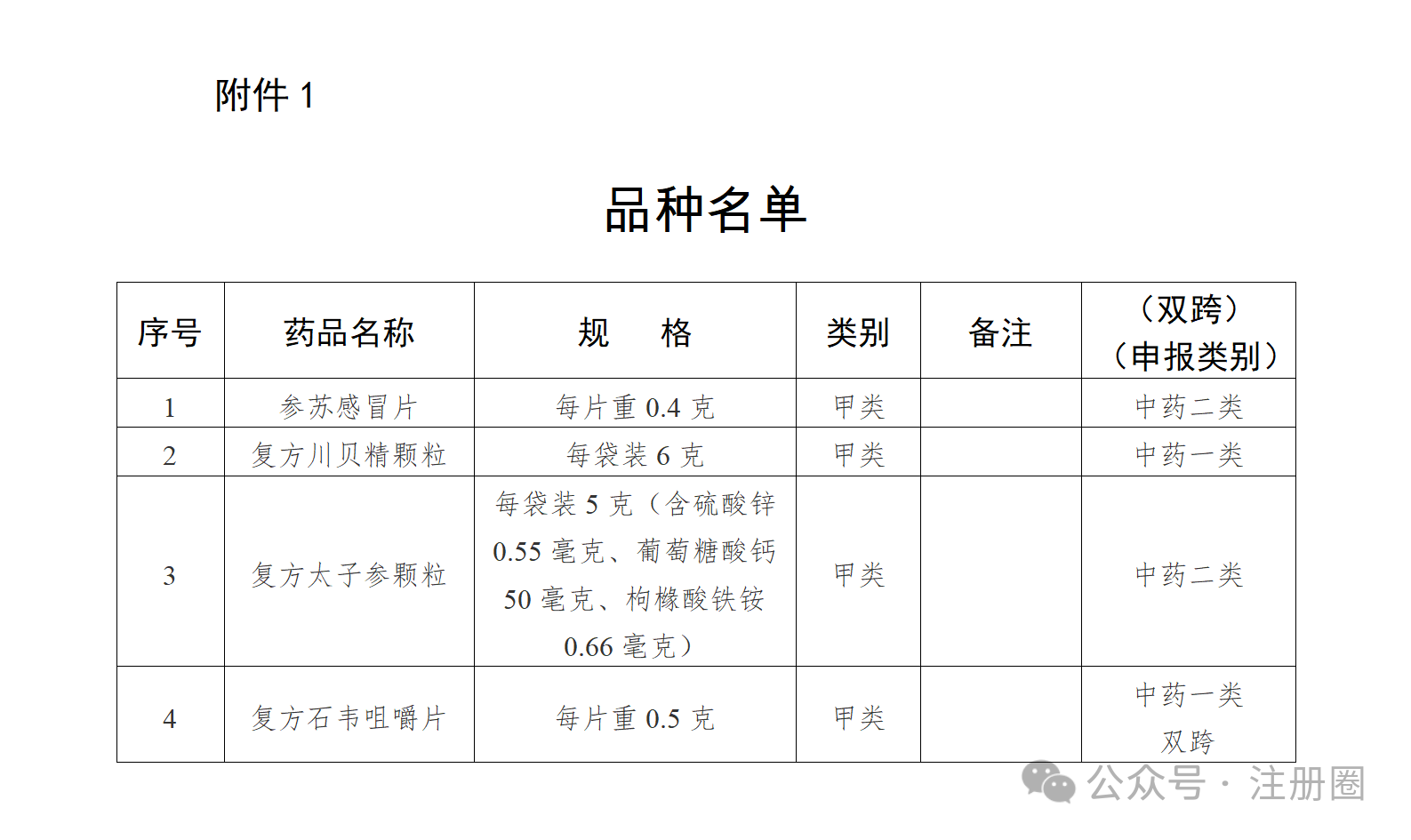

三、2024年08月16日中药品种保护受理公示
网址:
https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20240816142749117.html


(一)关于公开征求《山东省放射性药品经营质量管理实施细则(征求意见稿)》意见的通知http://mpa.shandong.gov.cn/art/2024/8/13/art_101797_10396184.html为加强放射性药品经营质量管理,规范企业经营行为,保障放射性药品的安全、有效、可及,根据《药品管理法》《放射性药品管理办法》《药品经营质量管理规范》等法律法规规章规定,结合我省放射性药品监管工作实际,省药监局起草了《山东省放射性药品经营质量管理实施细则》(以下简称《细则》),现面向社会公开征求意见。请填写征求意见反馈表(附件3),于2024年9月12日前反馈至电子邮箱ypscc@shandong.cn,邮件主题请注明“放射性药品经营意见反馈”。附件: 1.山东省放射性药品经营质量管理实施细则(征求意见稿)2.山东省放射性药品经营质量管理实施细则(征求意见稿)的起草说明(一)关于公开征求《关于调整药品零售连锁总部事权的公告》修改意见的公告<br/>(2024年 第20号)http://da.jiangsu.gov.cn/art/2024/8/12/art_84627_11322194.html
根据《药品经营和使用质量监督管理办法》(国家市场监督管理总局令第84号)有关规定,我局研究起草了《关于调整药品零售连锁总部事权的公告(征求意见稿)》(附件1),现向社会公开征求意见。
如有修改意见建议,请填写《意见反馈表》(附件2),于2024年9月13日前反馈至电子邮箱:zhuwh@da.js.gov.cn,电子邮件主题请注明“零售连锁总部事权征求意见反馈”。附件:1.关于调整药品零售连锁总部事权的公告(征求意见稿).pdf(二)关于公开征求《江苏省药品监督管理局关于进一步做好药品经营监督管理有关工作的通知(征求意见稿)》意见建议的公告(2024年 第21号)http://da.jiangsu.gov.cn/art/2024/8/12/art_84627_11322381.html为认真贯彻实施《药品经营和使用质量监督管理办法》以及《国家药监局关于进一步做好药品经营监督管理有关工作的公告》,进一步加强药品经营许可管理,切实规范药品经营行为,保障药品经营和使用环节质量安全,结合实际,我局研究起草了《江苏省药品监督管理局关于进一步做好药品经营监督管理有关工作的通知(征求意见稿)》(附件1),现向社会公开征求意见。如有修改意见建议,请填写《意见建议反馈表》(附件2),于2024年9月13日前反馈至电子邮箱:yul@da.js.gov.cn,电子邮件主题注明“药品经营监督管理文件征求意见反馈”。附件:1.江苏省药品监督管理局关于进一步做好药品经营监督管理有关工作的通知(征求意见稿).pdf(三)江苏省药品监督管理局关于公开征求第十七批28个品种江苏省中药配方颗粒标准意见的公告(2024年 第22号)http://da.jiangsu.gov.cn/art/2024/8/15/art_84627_11326810.html根据《关于制定江苏省中药配方颗粒标准(试行)的通知》(苏药监办审批〔2021〕28号),第十七批28个品种的江苏省中药配方颗粒标准(公示稿)已经江苏省药品监督管理局审评中心审评,现向社会公开征求修改意见。如有意见建议,请于2024年8月19日至9月19日期间,将具体修改意见及姓名、联系方式等信息通过电子邮件的形式反馈至江苏省药品监督管理局审评中心,联系人:李洁,联系电话:025-84530382,电子邮箱:JSPCCYPSPK@126.com;江苏省药品监督管理局联系人:简祖强,联系电话:025-83273916。附件:江苏省中药配方颗粒标准(第十七批公示稿).pdf(四)关于发布2024年江苏省药品监督管理局药品监管科学科研计划项目申报指南的通知(苏药监法科〔2024〕64号)http://da.jiangsu.gov.cn/art/2024/8/16/art_84605_11327026.html
各设区市市场监督管理局,省局各处室、检查分局、直属单位,各有关单位:
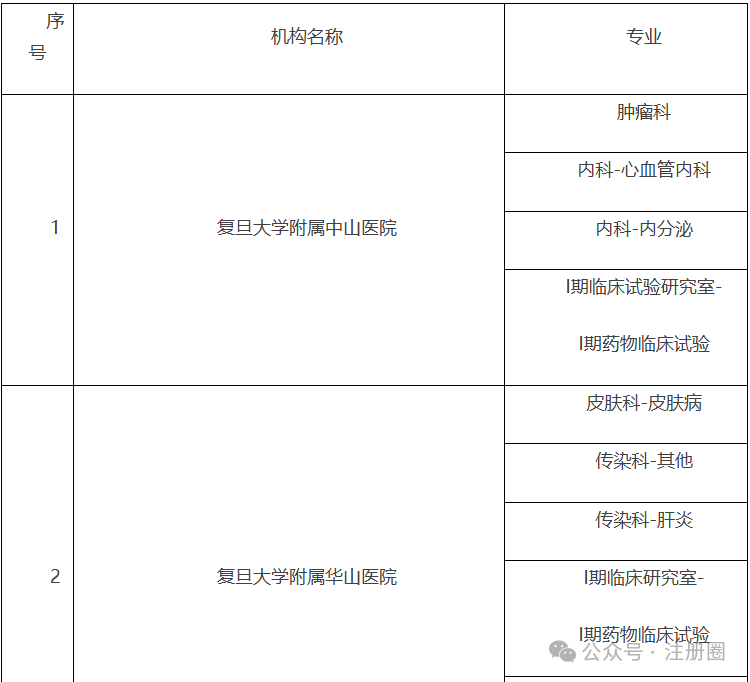
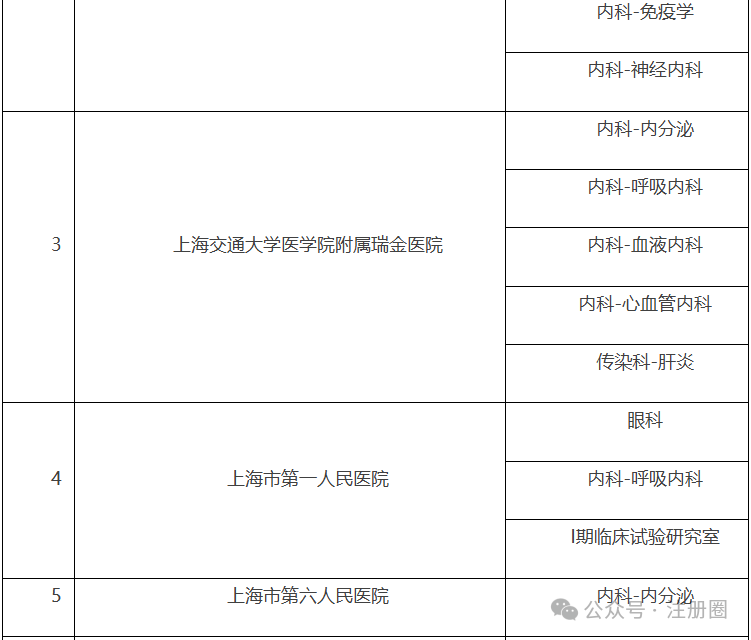
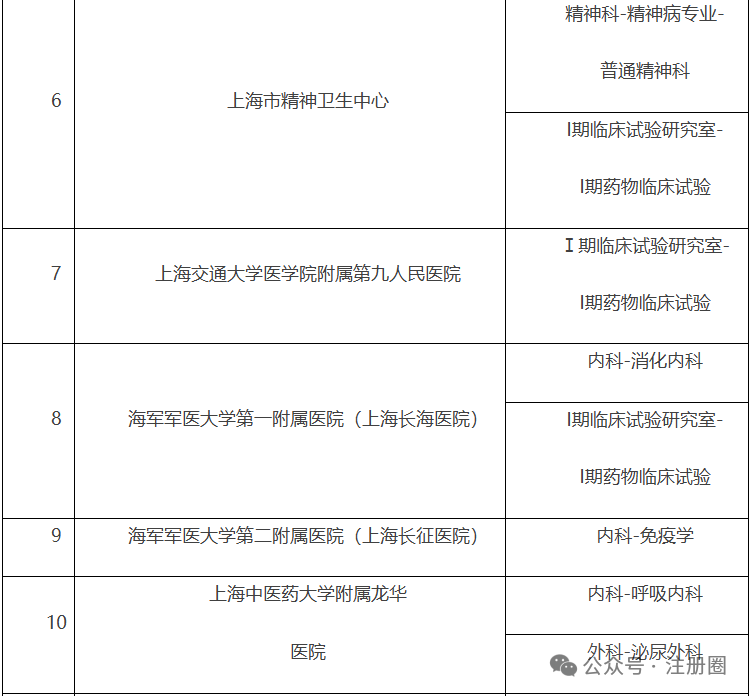
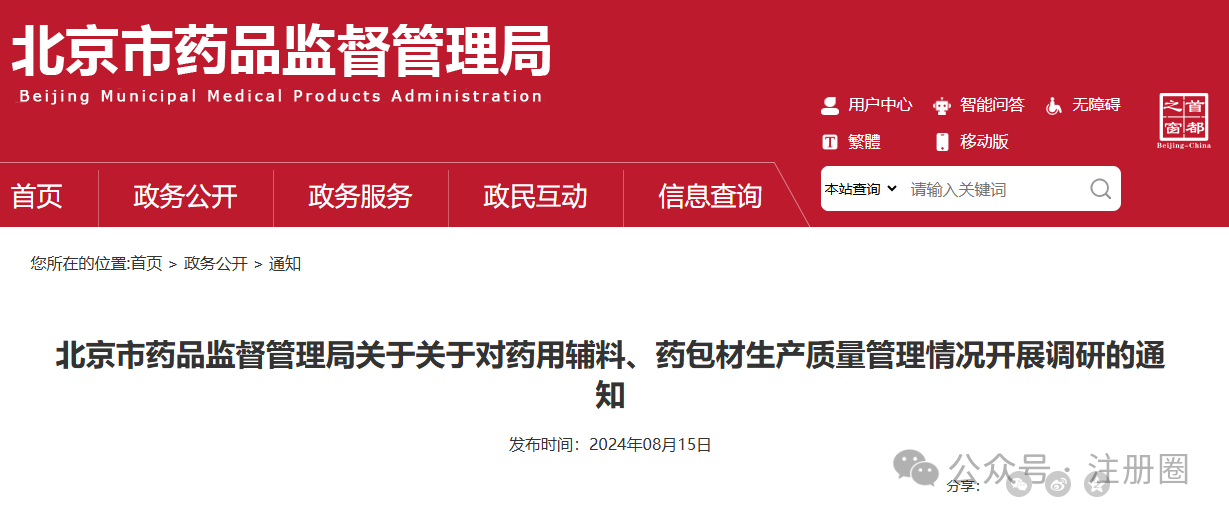
为深入贯彻党的二十届三中全会精神,根据省局2024年工作要点的总体部署及征集的药品监管科学科研计划项目需求,按照《江苏省药品监督管理局药品监管科学科研计划项目管理办法(试行)》(苏药监法科〔2023〕60号),现将省局2024年度药品监管科学科研计划项目申报指南予以发布,请按照申报指南要求开展项目申报工作并就有关事项通知如下:1.申报单位根据《2024年江苏省药品监督管理局药品监管科学科研计划项目申报指南》(附件1)提交申报材料。2.省局对申报项目组织审核。对拟同意立项的项目按照重大项目、应急攻关项目、一般项目(青年项目)进行划分,下达立项通知,并与承担单位签订项目任务书(合同书)。1.《江苏省药品监督管理局药品监管科学科研计划项目申报书》(附件2)纸质版一式三份,项目成员签字,加盖单位公章;并提供项目申报书word版电子文档(邮箱:fkcjsyjj@126.com);3.项目申报人所在单位开具的申报项目无重复申报证明;江苏省南京市鼓楼区鼓楼街5号华阳大厦省药品监管局政策法规处(科技处),联系电话:025-83273647。(注:请在信封上注明“科研项目申报”)。材料报送截止时间为2024年8月30日,以邮戳寄出时间为准。1.2024年江苏省药品监督管理局药品监管科学科研计划项目申报指南.pdf2.江苏省药品监督管理局药品监管科学科研计划项目申报书.docx问1:老师好,请问特殊需要药品购买证明从哪里申请?答:您好!特殊需要药品购买证明开具在江苏政务服务官网有相应的办理端口:进入江苏政务服务网(http://www.jszwfw.gov.cn/)首页——左侧专栏选择“采购在江苏”——特殊物品采购。(一)上海市药品监督管理局关于发布第一批优化创新药临床试验审评审批试点药物临床试验机构的公告https://www.shanghai.gov.cn/gwk/search/content/df429b286ee4439dad7ceec08206cdea根据《国家药监局关于印发优化创新药临床试验审评审批试点工作方案的通知》(国药监药注〔2024〕21号)和《上海市药品监督管理局关于印发<优化创新药临床试验审评审批试点的工作方案>的通知》(沪药监药注〔2024〕202号)有关要求,经对申报资料进行审核评估,确定本市14家药物临床试验机构(37个专业)为第一批优化创新药临床试验审评审批试点药物临床试验机构,名单见附件。附件:上海市优化创新药临床试验审评审批试点药物临床试验机构名单(第一批)上海市优化创新药临床试验审评审批试点药物临床试验机构名单(一)北京市药品监督管理局关于关于对药用辅料、药包材生产质量管理情况开展调研的通知https://yjj.beijing.gov.cn/yjj/zwgk20/tz7/543385864/index.html
各相关企业:
近日,国家药监局通过政府网对《关于发布<药用辅料生产质量管理规范》《药包材生产质量管理规范》的公告(征求意见稿)》(以下简称“《征求意见稿》”)公开征求意见。为进一步了解我市药用辅料、药包材生产企业的现状,我局拟组织相关企业调研。请各企业结合自身生产质量管理情况,围绕GMP管理理念、厂房设施设备、机构设置与人员培训、生产管理与质量保证、接受药品上市许可持有人(药品生产企业)审核等情况,全面评估企业的现行状况,对照《征求意见稿》逐条梳理存在的差距,并制定改进提升的计划。请8月19日前将差距分析结果与改进提升计划电子版报送我局,药用辅料企业报送邮箱vpscjgc@yi.beiing.gov.cn,药包材企业报送邮箱fmxzhy@126.com。我局将结合企业报送情况开展座谈及现场走访,(联系人及联系电话:姚珏成,18010283019;冯欣,18010281581;范妙璇,18010281080)(二)北京市药品监督管理局关于发布第二批优化创新药临床试验审评审批 试点药物临床试验机构的公告https://yjj.beijing.gov.cn/yjj/zwgk20/gg17/543385873/index.html根据《国家药监局关于印发优化创新药临床试验审评审批试点工作方案的通知》(国药监药注(2024)21号)和《北京市药品监督管理局关于开展优化创新药临床试验审评审批试点工作的通知》(京药监发(2024)159号)有关要求,经对药物临床试验机构提交的申请资料进行审核,确定北京大学人民医院等6家药物临床试验机构为第二批优化创新药临床试验审评审批试点药物临床试验机构,名单见附件。
附件:第二批优化创新药临床试验审评审批试点药物临床试验机构名单
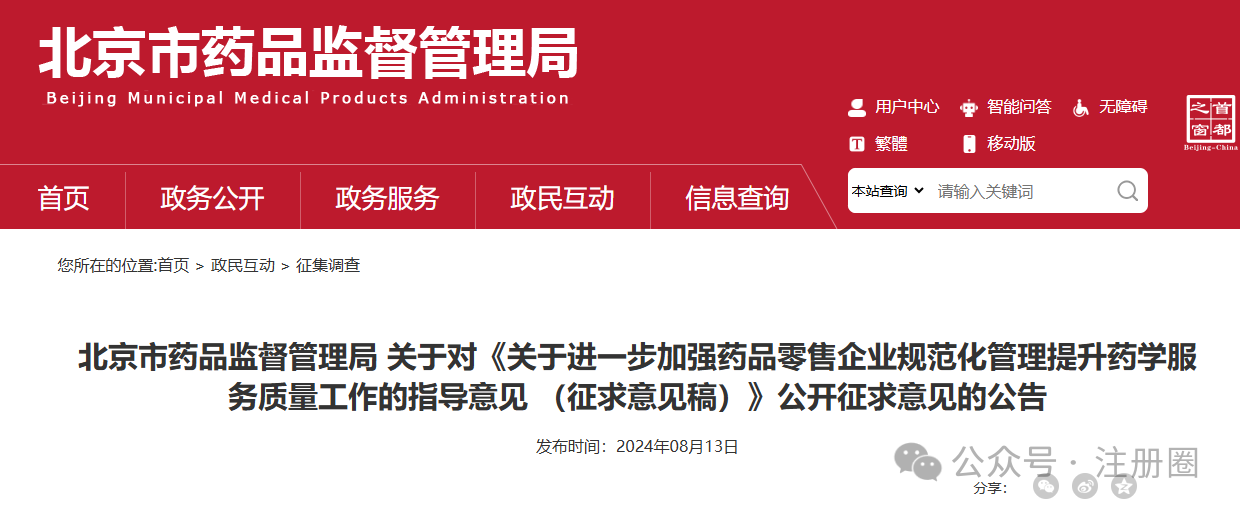
(三)北京市药品监督管理局 关于对《关于进一步加强药品零售企业规范化管理提升药学服务质量工作的指导意见 (征求意见稿)》公开征求意见的公告 https://yjj.beijing.gov.cn/yjj/zwhd17/zjdc38/543384122/index.html为进一步加强药品零售企业规范化管理,保障公众用药安全,我局制定了《关于进一步加强药品零售企业规范化管理提升药学服务质量工作的指导意见(征求意见稿)》,现面向社会公开征求意见。公众可通过以下途径和方式提出反馈意见:
公开征集意见时间为:2024年8月13日至9月12日。1.电子邮件:填写意见反馈表(附件3),发送至shichangchu@yjj.beijing.gov.cn,邮件主题请注明“加强药品零售企业规范化管理提升药学服务质量工作的指导意见反馈意见”;2.邮寄通信地址:填写意见反馈表(附件3),邮寄至北京市通州区留庄路6号院2号楼629室,北京市药品监督管理局药械流通处,邮政编码:101100。(请在信封上注明“意见征集”字样);4.登录首都之窗(http://www.beijing.gov.cn),在“政民互动”版块下的“政策性文件意见征集”专栏中提出意见。附件:1.《关于进一步加强药品零售企业规范化管理提升药学服务质量工作的指导意见(征求意见稿)》2.《关于进一步加强药品零售企业规范化管理提升药学服务质量工作的指导意见(征求意见稿)》起草说明声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容