
2021-03-22 11:03:30来源:康橙投资浏览量:1808
至今还清晰记得报考研究生选专业的时候自己非常坚决地选择了药物化学,在我当时有限的书本知识范围里,小分子靶向药物的春天就要来了,而我蠢蠢欲动,想做那“站在风口的猪”。研究生入学是2014年,也正是PD-1单抗上市的元年,BMS的Opdivo(O药)与MSD的Keytruda(K药)相继成功上市,并以摧枯拉朽之势迅速拿下多个肿瘤适应症。再到后来基因疗法、细胞疗法等多种创新生物技术的层出不穷,我想可能很多从事小分子药物研发的人和我一样如坐针毡,这也迫使我在五年研究生阶段一直到后来参加工作都在思考小分子药物“尚能饭否”这个问题。关于这个问题,我和同学、同事以及导师都有过多次激烈的讨论,终究也没有谁能完全说服对方,小分子药物与生物创新疗法(包括抗体、基因疗法、细胞疗法等)的博弈,到底是“愈久弥香”还是“长江后浪拍前浪”,我想结论还是留给时间来检验。
回顾创新药近20年的销售数据,我们发现在2000年全球销售额Top10创新药中8个为小分子药物,从2008年开始Top10销售额创新药中的小分子药物开始小于等于5个,到2019年Top10中仅有4个为小分子,小分子药物逐步失去了销售额的头把交椅,在整体销售额中的占比也呈现逐步下降趋势。在众多潜力生物技术疗法的冲击下,小分子药物的市场正在逐步被侵蚀,更有悲观者担忧随着层出不穷生物疗法的涌现,小分子药物是否可能最终逐步退出历史的舞台。
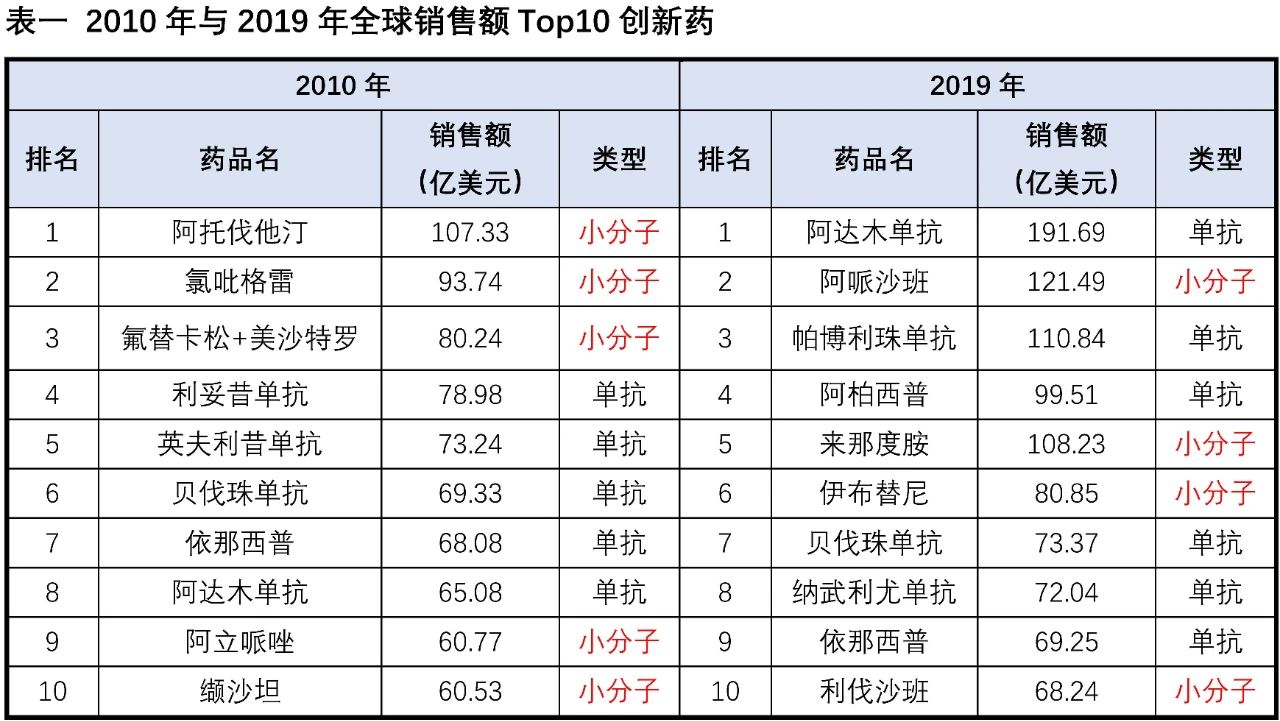
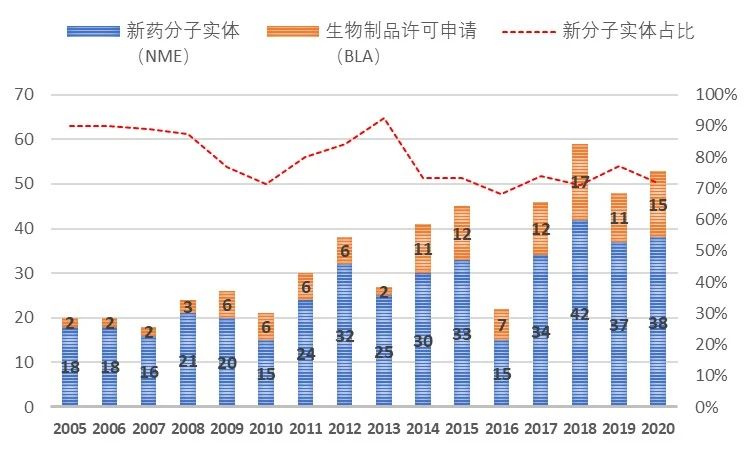
小分子药物从最早罂粟中的吗啡、柳树中的水杨酸到上个世纪出现历史上第一个年销售额超10亿美元的“重磅炸弹”药物-地西泮,到2001年第一个针对癌细胞特定基因突变的靶向小分子药格列卫,再到如今有获批超过60个的激酶抑制剂小分子,小分子药物的开发经历了辉煌的历史。从2005-2020年FDA批准的新药统计数据可以看出,新分子实体(即小分子药物)的占比从2005的90%左右,逐步下降到70%附近,并呈现进一步缓慢下降的趋势。小分子药物的开发貌似进入了“前狼后虎”的困境期,当前小分子药物的开发不仅受限于新靶点发现与小分子库多样性的增速逐年降低,使得小分子药物的开发一直保持相对较低的成功率(小分子靶向药物成功率均值约为11%,肿瘤药物的成功更是低至5%),同时还受到抗体、基因疗法、细胞疗法、ADC、溶瘤病毒等众多创新生物技术对相同适应症市场的围住堵截。在尚未充分开拓的适应症市场(包括各类罕见病),新开发的生物技术疗法同样表现出非常好的潜力与优势,如血友病(双抗药物Hemlibra与基因疗法ValRox)、地中海贫血症(基因疗法Zyntegl)、三阴性乳腺癌(ADC药物-Sacituzumab Govitecan)、家族性淀粉样多发性神经病变(siRNA药物-Patisiran)等。
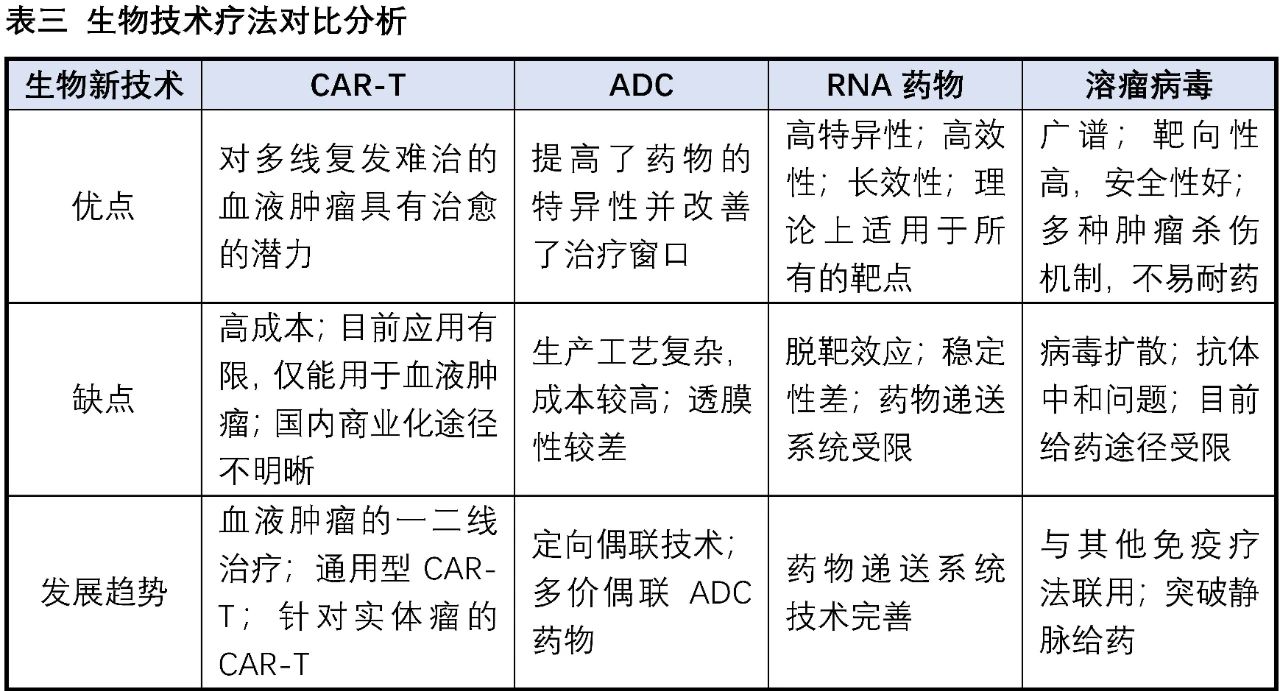
在巨大的医药市场与强大的社会责任感的驱使下,全球主要经济体都在竭尽所能努力发展生物医药产业,各种创新生物技术疗法如雨后春笋般涌现,为广大的病患带来更多恢复健康、延长寿命的选择。目前已经有成功上市产品的生物技术疗法包括抗体药物、ADC、CAR-T细胞疗法、基因疗法、RNA药物、溶瘤病毒等,其中抗体药物的发展最为成熟,以2019年为例,销售额Top10中有6个为抗体药物。下表我们以小分子药物与抗体药物的对比为例,来探讨小分子药物与创新生物技术的优劣势。
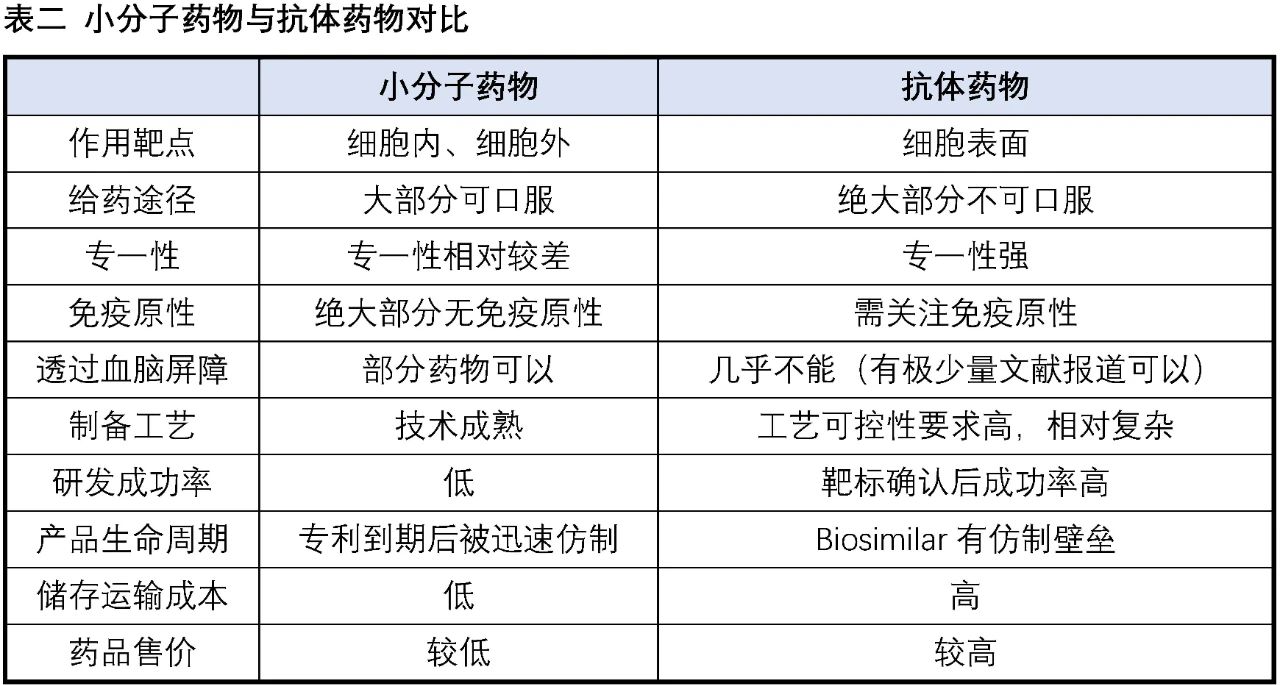
相对大分子抗体药物等生物技术,小分子药物的优势:
(1)大部分的小分子药物可以口服,给药方便,相比之下绝大部分的生物技术产品都采用注射类给药方式,患者依从性差。
(2)小分子药物能很好地作用于细胞内(包括细胞核内靶点)与细胞外的靶点。
(3)部分小分子药物能通过血脑屏障,可用于脑部疾病治疗,目前作用于中枢神经体统的药物依然以小分子为主。
(4)小分子药物对储存环境的敏感性相对较低,储存运输方便。
(5)几乎没有免疫原性,生物技术产品如抗体、基因治疗的AAV病毒等都有可能被免疫系统识别为抗原激发免疫反应。
(6)小分子药物相对更容易实现差异化,这受益于小分子药物众多且相对成熟的靶点,同时针对小分子进行的微小改动往往能收获意向不到的效果(如代谢改善、选择性提高、毒性降低等)。相比之下生物技术相关疗法的起步相对较晚,技术相对不是那么成熟,从而使得同一技术在相同领域容易出现严重的同质化现象,如“百家争鸣”的PD-1/PD-L1抗体、CD-19-CAR-T细胞疗法(这两个产品的国内临床试验登记项目数量都超过了100家)。
相对大分子抗体药物等生物技术,小分子药物的劣势:
(1)对于没有适合作用口袋的靶点较难开发,比如蛋白质-蛋白质相互作用界面一般大而平坦,没有很好的口袋容纳小分子,而利用大分子药物比如拥有类似作用面的抗体来干扰却特别有效。
(2)特异性不高,小分子药物由于结构相对较小,往往容易对多个靶点有活性,这也是许多小分子药物副作用大的原因。
(3)半衰期短,往往需要一日一次甚至一日多次服用。
(4)开发成功率较低,以抗体药物为例的整体研发成功率约为20%,相比之下小分子药物整体研发成功率仅为约11%。
(5)制备工艺相对简单成熟。这一点既是优势也是劣势,相对简单成熟的制备工艺使得小分子药物的生产成本远低于其他生物技术产品,同时正是相对简单成熟的制备工艺,当一种小分子药物的专利到期时,仿制药能以相对低廉的成本抢占原研市场,造成小分子药物的“专利悬崖”。
小分子药物作为最传统的药物形式,虽然当前的发展遇到一些困境,但也有其难以替代的优势。ADC、细胞疗法、基因治疗等新药物形式正在逐步兴起,在多个治疗领域表现自己独到的优势和惊人的潜力,但同时也面临着各自的严峻挑战,相信在不久的将来也会是多种药物形式共存的竞争格局,各类疗法的追随者也会努力在自己的领域寻求突破。
三、 小分子的出路—“长出一个小翅膀,就能飞得更高”
“站在风口上猪都能飞起来”后面其实还有下半句—“长出一个小翅膀,就能飞得更高”。小分子药物作为曾经“站在风口的猪”,当前的发展虽然遭遇困境,但是只要在某些关键点做出新的突破,为自己加上一个小翅膀,我想小分子药物的未来当然可以更高更远。随着分子生物学、结构生物学的快速发展,小分子药物发现进入基于靶点的药物设计的时代,我们能够基于某个靶点进行高通量筛选,可以获得小分子和靶蛋白的复合晶体结构,在计算机的辅助下进行合理优化,药物的研发变得如此清晰。高通量筛选(High Throughput Screening,HTS)、虚拟筛选(Virtual Screening)、基于结构的药物设计(Structure-based Drug Design,SBDD)以及基于片段的药物设计(Fragment-based Drug Discovery,FBDD)逐渐成为小分子药物研发的常见技术。这些技术取得了很大的成功,也仍然在不断丰富和发展中,然而小分子药物发现的效率并没有如人们期待的那样大幅提高。近几年小分子领域也在出现诸多新的思路,实现新的突破,小编认为小分子可能在如下几个方面实现突破:PROTAC技术、分子胶、变构调节、老药新用。
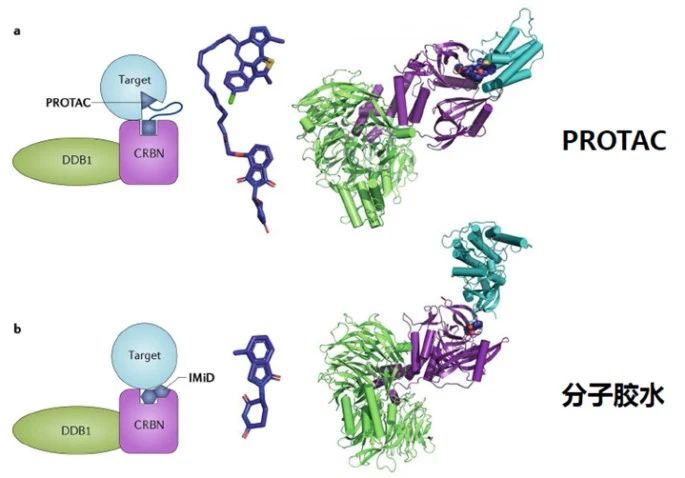
PROTAC(Proteolysis Targeting Chimera,蛋白降解靶向嵌合体)是一种双功能小分子,由靶蛋白配体和E3泛素连接酶配体通过Linker连接得到,利用泛素-蛋白酶系统识别、结合并降解疾病相关的靶蛋白。该技术最早由Raymond Deshaies等人在2001年提出,理论上可以将任何过表达和突变的致病蛋白清除,从而治疗疾病。
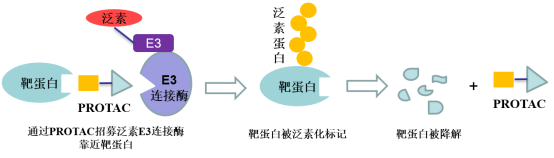
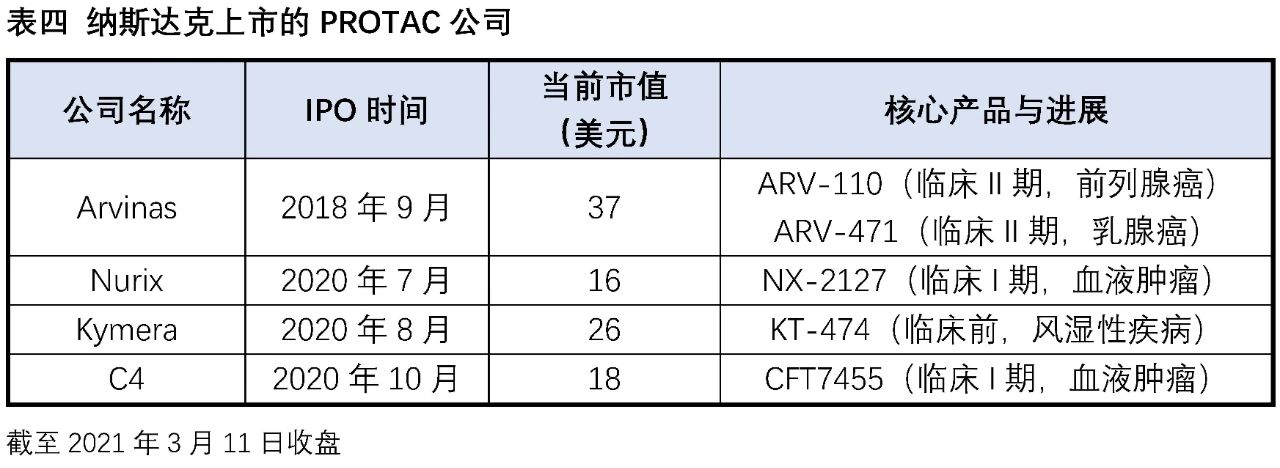
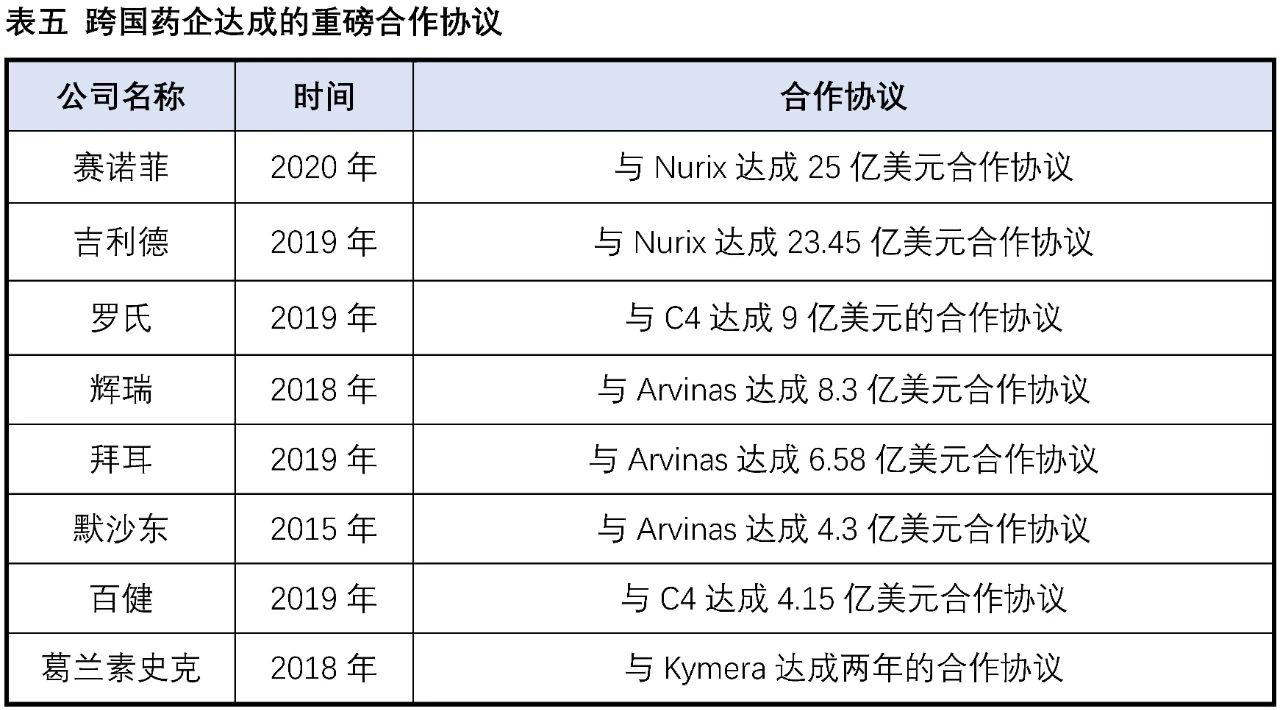
实际在临床上也有部分药物被意外发现具有降解靶蛋白的作用:比如乳腺癌治疗药物氟维司群可以降解雌激素受体;来那多胺可以特异性降解转录因子IKZF1和IKZF3;第三代EGFR抑制剂奥希替尼也能选择性诱导EGFR-T790M的降解。这些意外的发现没有普适性,也较难通过合理设计来得到。PROTAC作为主观设计的降解靶标蛋白的小分子,在肿瘤、自身免疫性疾病领域已经取得了惊人的进展,同时在“不可成药靶点”与当前疗法耐药患者治疗中表现出巨大的潜力,获得了科学界和资本市场的广泛认可,目前已有多家PROTAC公司登陆纳斯达克,多家跨国药企也积极参与布局该赛道,达成了多笔重磅合作协议。PROTAC技术戴着“明星光环”前行,是否能够带领小分子药物再度崛起,取决于未来几年相关产品的临床进展。
分子胶(Molecular Glues)是一类可以诱导或稳定蛋白质间相互作用的小分子化合物。当其中一个蛋白质分子为泛素连接酶时,分子胶可以引起另外一个蛋白质发生泛素修饰,并通过蛋白酶体途径发生降解,与PROTAC有异曲同工之妙。经典的分子胶降解剂如沙利度胺类似物和芳基磺酰胺类抗癌药Indisulam等都是利用E3泛素连接酶与靶蛋白之间的互补蛋白-蛋白作用界面,重编程泛素连接酶的选择性,以催化剂的方式驱动靶点泛素化。因此,分子胶也巧妙地避开了传统抑制剂的局限性,使得一部分靶点从“无成药性”变为“有成药性”,同时分子胶相比PROTAC有更小的分子量,理论上会有更好的成药性。早期发现的分子胶也多是偶然所得,近年来主动设计的分子胶也取得了不错的进展。2020年11月,礼来制药与万春医药子公司万春Seed完成签署总金额达到7.9亿美元的合作,将借助Seed自主研发的独特分子胶蛋白降解专利技术开发候选新药。2020年12月,分子胶技术公司Neomorph宣布完成1.09亿美元的A轮融资,用以推进专有的靶向蛋白降解平台以及相关项目的发展。同月,勃林格殷格翰也在分子胶领域有所布局,与Proxygen签订了合作和授权协议,共同开发靶向多种致癌靶点的分子胶降解剂。2021年3月,Monte Rosa Therapeutics宣布完成9500万美元的C轮融资用于将其主要分子胶产品推入临床,加速管线发展并增强平台能力。
变构调节(Allosteric Regulation)通过特异性影响蛋白构象变化,从而将其稳定在某个非活化或活化状态,这与传统的底物竞争性抑制剂比如ATP竞争性激酶抑制剂有所不同。变构调节中有一个有趣的“胖子理论”,以激酶抑制剂设计为例,激酶底物比如ATP与酶活性中心结合紧密,就像是一个胖子坐在一把椅子上。传统的竞争性抑制剂要把这个胖子拉起来,需要更大的力气,也就是更高的亲合力。而变构抑制剂则是在椅子的某处扎了一根钉子,胖子自己就跳起来了,并不需要多大的力气。变构调节因为其“四两拨千斤”的独特机制,不仅具有更好的选择性、安全性和克服耐药的潜力,还能使得一部分靶点从“无成药性”变为“有成药性”,引起了众多科研机构和制药企业的重点关注。随着结构生物学的发展,变构位点的确认变得相对容易,也进一步推动了变构调节小分子药物的开发。
诺华的BCR-ABL1变构抑制剂Asciminib,与BCR-ABL1蛋白的肉豆蔻酰基位点结合(非ATP结构位点),通过不同于其他BCR-ABL1激酶抑制剂的机制将BCR-ABL1锁定为无活性构象。Asciminib在用于曾接受过两种以上酪氨酸激酶抑制剂(TKI)治疗,并且对最近接受的TKI治疗产生耐药性或不耐受的慢性髓系白血病(CML)患者的3期临床试验的初步分析中达到主要临床终点,并于近期获得FDA授予的2项突破性疗法(Breakthrough Therapy)资格。最近两年比较火热的KRAS抑制剂(如AMG510,临床III期,已提交上市申请)、SHP2抑制剂(TNO155,临床II期)都是相应靶点的变构抑制剂,均是“不可成药靶点”的伟大突破。
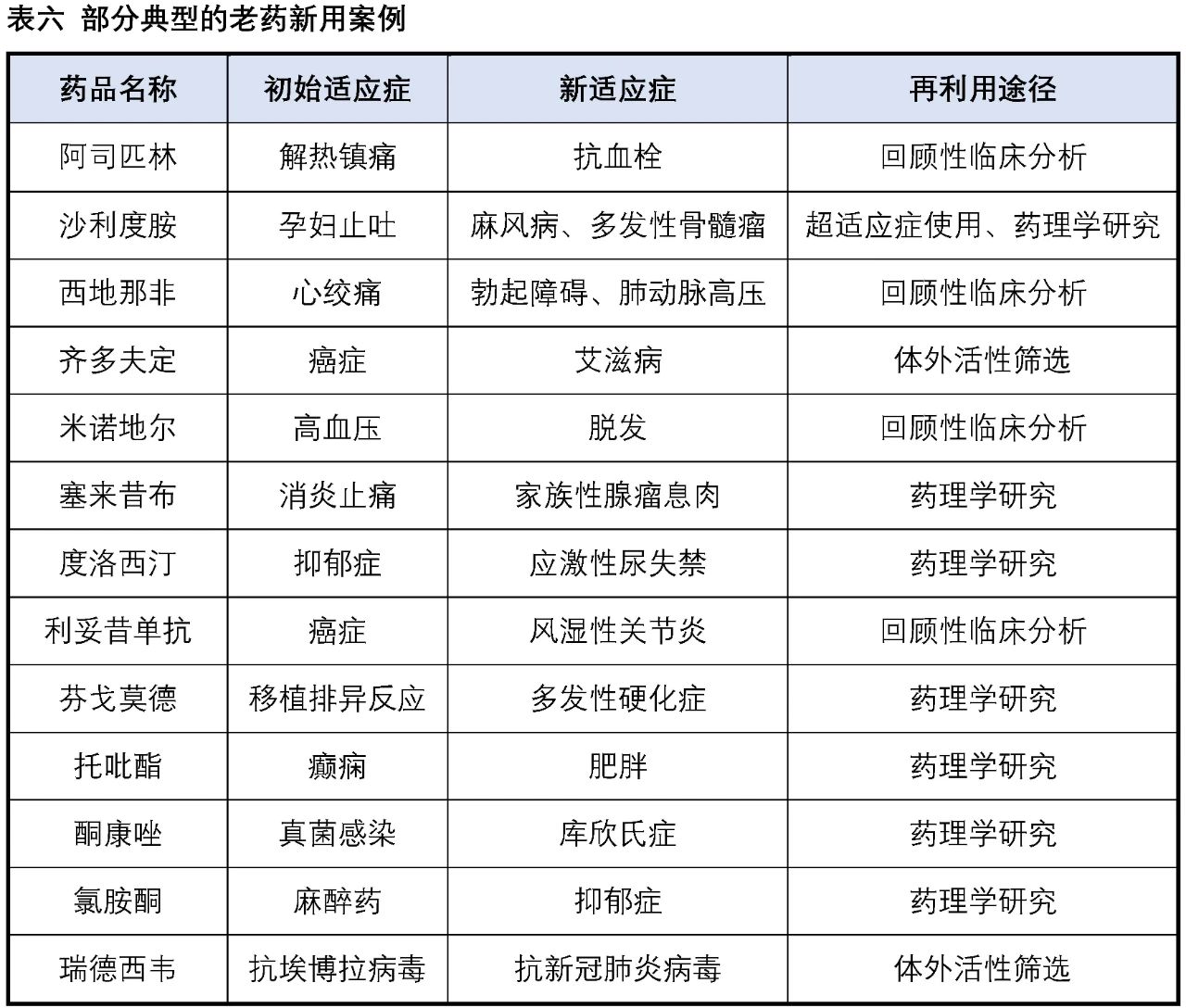
“The best way to discover a new drug is to start with an old one”,这是1988年诺贝尔生理学或医学奖获得者药理学家James Black提出的,简而言之就是“老药新用”。“老药”是指已上市的药物或正在进行临床试验的药物,“新用”是指发现在新的适应症上使用这些药物。
阿司匹林于1899年在美国被发明,作为解热镇痛药的应用已有百余年,随着临床研究的不断深入,阿司匹林的许多新功效和新作用逐渐被发现,特别是其心血管疾病预防和治疗中的作用。《中国心血管病预防指南(2017)》中开始将低剂量阿司匹林作为心血管疾病预防的基础药物。臭名昭著的沙利度胺同样也是老药新用的经典案例,20世纪50年代沙利度胺(商品名:反应停)成功在欧洲上市,在短短几年时间里就造成了全球上万例新生儿畸形(海豹胎),成为药物史上最大的悲剧之一,使得该药品于1963年被迫退市。1964年医生在给麻风病患者使用时,结果意外发现沙利度胺可以有效地减轻患者的皮肤症状。20世纪90年代又陆续发现了抗炎、抗肿瘤作用,1998年沙利度胺被FDA批准用于多发性骨髓瘤的治疗。西地那非(商品名:万艾可)最初开发是用于扩张心血管平滑肌以扩张血管治疗心绞痛,但是疗效不尽人意,同样的作用机制,临床上发现其对阴茎海绵体平滑肌的舒张作用却很显著。1998年,FDA正式批准西地那非用于勃起功能障碍治疗。
资料来源:康橙投资
在氘代药物、共价抑制剂、多肽药物等发展相对成熟的技术方面,小分子药物也很有可能迎来突破。随着人工智能(AI)技术的不断成熟以及在新药研发中的不断渗透,人工智能在靶点发现、苗头化合物与先导化合物发现、药物分子合成路线设计、疾病模型建立、新适应症挖掘等诸多方面助力新药研发,将大大提高新药的研发效率。近日,AI制药巨头强强联合,Roivant拟以20.5亿美元收购Silicon Therapeutics(首付款4.5亿美金+里程碑付款);国内互联网巨头BAT(百度、阿里、腾讯)近年来也投入大量精力积极布局AI药物发现,相信借助人工智能技术不论是小分子药物还是大分子药物都能迎来蓬勃发展的时机。小分子药物有其难以替代的优势,它的发展也是困境与突破交替轮动的历史,随着各种新科技的不断涌现,我们也期待能有更多的“黑科技”助力小分子药物研发的突破,给世界带来更多的惊喜。
勇当主角,甘当配角。小分子药物在药物发展史的中一直担任“主角”,随着各种生物技术疗法的日益丰富与成熟,疾病的治疗手段必然会呈现百花齐放的趋势。近年来联合用药也逐渐成为临床试验发展的趋势,特别是肿瘤免疫疗法的兴起,更是进一步推动了联合用药方案的尝试与突破。我想未来在某些疾病领域小分子药物依然会是“主角”,在另一些领域小分子药物可能真的会逐步被取代直至淘汰,在更多的领域将是小分子药物与生物技术疗法的“强强联合”,从而更好地为患者排忧解难。
作者简介
郭祖浩 博士
来源:康橙投资
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!