
2025-07-29 10:19:37来源:注册圈浏览量:602
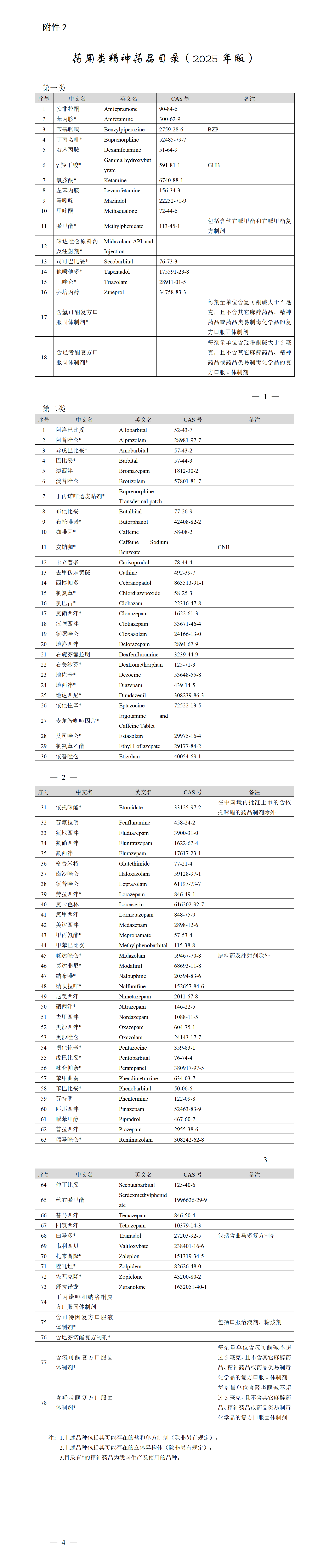
https://www.cde.org.cn/main/news/viewInfoCommon/74ec4ee60f06e4a3fc98f04e5e8b0e1c 特此通告。 附件:生物类似药药学相似性研究的问题与解答 国家药监局药审中心 2025年7月7日 https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypshmshxdgg/20250721152919174.html 根据药品不良反应评估结果,为进一步保障公众用药安全,国家药监局决定对复方甘草酸单铵S注射剂(包括注射用复方甘草酸单铵S、复方甘草酸单铵S氯化钠注射液、复方甘草酸单铵S注射液)说明书内容进行统一修订。现将有关事项公告如下: 一、所有上述药品的上市许可持有人均应当依据《药品注册管理办法》等有关规定,按照附件要求修订说明书,于2025年10月17日前报省级药品监督管理部门备案。 修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。自备案之日起生产的药品,不得继续使用原药品说明书。药品上市许可持有人应当在备案后9个月内对已出厂的药品说明书及标签予以更换或者以其他形式将说明书更新信息告知患者。 二、药品上市许可持有人应当对新增不良反应发生机制开展深入研究,采取有效措施做好药品使用和安全性问题的宣传培训,指导医师、药师合理用药。 三、临床医师、药师应当仔细阅读上述药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的获益/风险分析。 四、患者用药前应当仔细阅读药品说明书,使用处方药的,应当严格遵医嘱用药。 五、省级药品监督管理部门应当督促行政区域内上述药品的上市许可持有人按要求做好相应说明书修订和标签、说明书更换及说明书更新信息的告知工作,对违法违规行为依法严厉查处。 特此公告。 附件:复方甘草酸单铵S注射剂药品说明书要求 国家药监局 2025年7月18日 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/zhybhpzh/zhybhpzhgg/20250722092004119.html 根据《中药品种保护条例》规定,国家药品监督管理局批准天士力医药集团股份有限公司的痰咳净滴丸、石家庄以岭药业股份有限公司的夏荔芪胶囊、湖南德康制药股份有限公司的紫贝止咳颗粒和江西华太药业有限公司的金丹附延颗粒为首家中药二级保护品种,保护品种编号分别为:ZYB2072025018、ZYB2072025019、ZYB2072025020、ZYB2072025021。保护期限自公告日起七年。 特此公告。 国家药监局 2025年7月16日 三、国家药监局关于中药保护品种的公告(延长保护期第23号)(2025年第70号) 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/zhybhpzh/zhybhpzhgg/20250722092257197.html 根据《中药品种保护条例》第十六条及有关规定,经国家中药品种保护审评委员会组织的委员审评,国家药监局核准: 对广东万方制药有限公司的百合固金片继续给予二级保护,其保护期限、保护品种编号为2025年7月16日—2031年7月19日、ZYB20720250021。 特此公告。 国家药监局 2025年7月16日 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20250724101644155.html 根据《处方药与非处方药分类管理办法(试行)》(原国家药品监督管理局令第10号)规定,经国家药监局组织论证和审核,人参北芪胶囊和脑心舒口服液由处方药转换为非处方药。品种名单(附件1)及非处方药说明书范本(附件2)一并发布。 请相关药品上市许可持有人于2026年4月15日前,依据《药品注册管理办法》(市场监管总局令第27号)等有关规定,就修订说明书事项向省级药品监督管理部门备案,并将说明书修订的内容及时通知相关医疗机构、药品经营企业等单位。 非处方药说明书范本规定内容之外的说明书其他内容,按原批准证明文件执行。药品标签涉及相关内容的,应当一并修订。自补充申请备案之日起生产的药品,不得继续使用原药品说明书。 特此公告。 附件:1.品种名单 2.非处方药说明书范本 国家药监局 2025年7月16日 五、国家药监局关于盐酸氨溴索滴剂处方药转换为非处方药的公告(2025年第73号) 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20250725151939147.html 根据《处方药与非处方药分类管理办法(试行)》(原国家药品监督管理局令第10号)的规定,经国家药品监督管理局组织论证和审核,盐酸氨溴索滴剂由处方药转换为非处方药。品种名单及其非处方药说明书范本一并发布。 请相关药品上市许可持有人在2026年4月22日前,依据《药品注册管理办法》等有关规定,向省级药品监督管理部门提交修订说明书备案,并将说明书修订内容及时通知相关医疗机构、药品经营企业等单位。 非处方药说明书范本规定内容之外的说明书其他内容按原批准证明文件执行。药品标签涉及相关内容的,应当一并修订。药品上市许可持有人提交备案之日起生产的药品,不得继续使用原药品说明书。 特此公告。 附件:1.品种名单 国家药监局 2025年7月23日 六、国家药监局 公安部 国家卫生健康委关于发布药用类麻醉药品和精神药品目录的公告(2025年第55号) 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20250728092519123.html 根据《麻醉药品和精神药品管理条例》第三条规定,国家药监局、公安部、国家卫生健康委制定了药用类麻醉药品目录(2025年版)和药用类精神药品目录(2025年版)(见附件),现予以发布,自发布之日起施行。 1.药用类麻醉药品目录(2025年版) 国家药监局 公安部 国家卫生健康委 一、山东省药品监督管理局 (一)关于公开征求《山东省药品监督管理局药品生产检查实施细则(征求意见稿)》意见建议的通知 网址: http://mpa.shandong.gov.cn/col/col101797/art/2025/art_7ee498dd93004a8b8c27559c7b6af336.html 为贯彻落实国务院办公厅《关于严格规范涉企行政检查的意见》(国办发〔2024〕54号)有关规定和国家药监局《药品检查管理办法(试行)》等要求,进一步规范我省药品生产检查行为、优化生产检查情形,提升药品生产监管效能,保障公众用药安全,服务我省医药产业高质量发展,依据相关法律、法规和规范性文件,我局起草了《山东省药品监督管理局药品生产检查实施细则(征求意见稿)》。现向社会各界公开征求意见,请于2025年8月23日前,将有关意见以电子邮件形式反馈我局。 邮 箱:ypshengchanchu@shandong.cn。 附件:山东省药品监督管理局药品生产检查实施细则(征求意见稿) 2025年7月23日 (二)2025省药监收费目录清单 网址: http://mpa.shandong.gov.cn/col/col101747/art/2025/art_85abb268b8d84f7287a8880f4d7c89d3.html 二、辽宁省药品监督管理局 (一)辽宁省药品监督管理局关于公开征求《辽宁省药品零售连锁企业使用电子随货同行单管理规定》意见的公告 网址: https://ypjg.ln.gov.cn/ypjg/gzhd/yjzj/2025072214153138044/index.shtml 为鼓励、引导药品零售连锁经营,助力企业高质量发展,保证药品质量安全,根据《中华人民共和国药品管理法》《中华人民共和国电子签名法》《药品经营和使用质量监督管理办法》《药品经营质量管理规范》等法律法规规范规定,省药监局起草了《辽宁省药品零售连锁企业使用电子随货同行单管理规定(征求意见稿)》,现向社会公开征求意见。请于2025年8月21日前将相关意见建议反馈至电子邮箱yhltjgc.fda@ln.gov.cn。电子邮件主题请注明“《管理规定》建议反馈”。 特此公告。 辽宁省药品监督管理局 2025年7月22日 辽宁省药品零售连锁企业使用电子随货同行单管理规定 (征求意见稿) 第一条为鼓励、引导药品零售连锁经营,助力企业高质量发展,保证药品质量安全,根据《中华人民共和国药品管理法》《中华人民共和国电子签名法》《药品经营和使用质量监督管理办法》《药品经营质量管理规范》等法律法规规范规定,结合我省实际,制定本规定。 第二条本规定的电子随货同行单是指药品零售连锁总部开展药品出库、送货确认,连锁门店开展收货、验收等活动时使用的电子凭证,其效力与纸质随货同行单相同。 第三条我省药品零售连锁企业可使用电子随货同行单从事相关经营活动,同时应遵守法律、法规、规章及本规定的相关要求。 第四条企业应当在统一的计算机管理系统控制和管理下,使用电子随货同行单开展相关经营活动,确保数据原始、真实、准确、安全和可追溯。 第五条连锁门店应配备辅助收货、验收的设施设备,与药品零售连锁总部、门店计算机管理系统实现药品质量基础数据同步共享、互联互通。 相关设施设备应具备按用户名密码权限登录、查询加盖出库专用章的电子随货同行单、显示待收货或验收药品信息、逐笔确认待收货与验收药品、记录异常药品信息、记录操作人员、操作时间等功能。 连锁门店辅助收货验收的设施设备可以为手机小程序,或扫码设备配合计算机管理系统等。 第六条待收货或验收药品信息至少包含药品的通用名称、上市许可持有人(中药饮片标明生产企业、产地)、批准文号、剂型、批号、数量、规格、有效期、销售日期等内容。 第七条连锁门店计算机管理系统应具备查询、下载、保存、打印收货验收后的电子随货同行单的功能。 收货验收后的电子随货同行单应注明供货单位名称、药品通用名称、药品上市许可持有人(中药饮片标明生产企业、产地)、批准文号、产品批号、剂型、规格、有效期、销售数量、销售价格、销售日期、验收结果、电子出库专用章、收货单位、收货地址、门店收货或验收人员等内容。 第八条企业相关记录和数据的存储、备份以及保存时限应当符合法律、法规、规章的规定。 第九条企业应建立使用电子随货同行单进行收货、验收、查询、存储的管理制度和操作规程;建立应急预案,应对停电等突发事件。对相关人员进行岗前培训,同时,按照本规定的要求开展内审和风险评估,切实保证药品经营活动持续符合法定管理要求。 第十条本规定自印发之日起施行。



四、国家药监局关于人参北芪胶囊和脑心舒口服液转换为非处方药的公告(2025年第71号)

2.非处方药说明书范本
特此公告。
附件:
2.药用类精神药品目录(2025年版)
2025年7月21日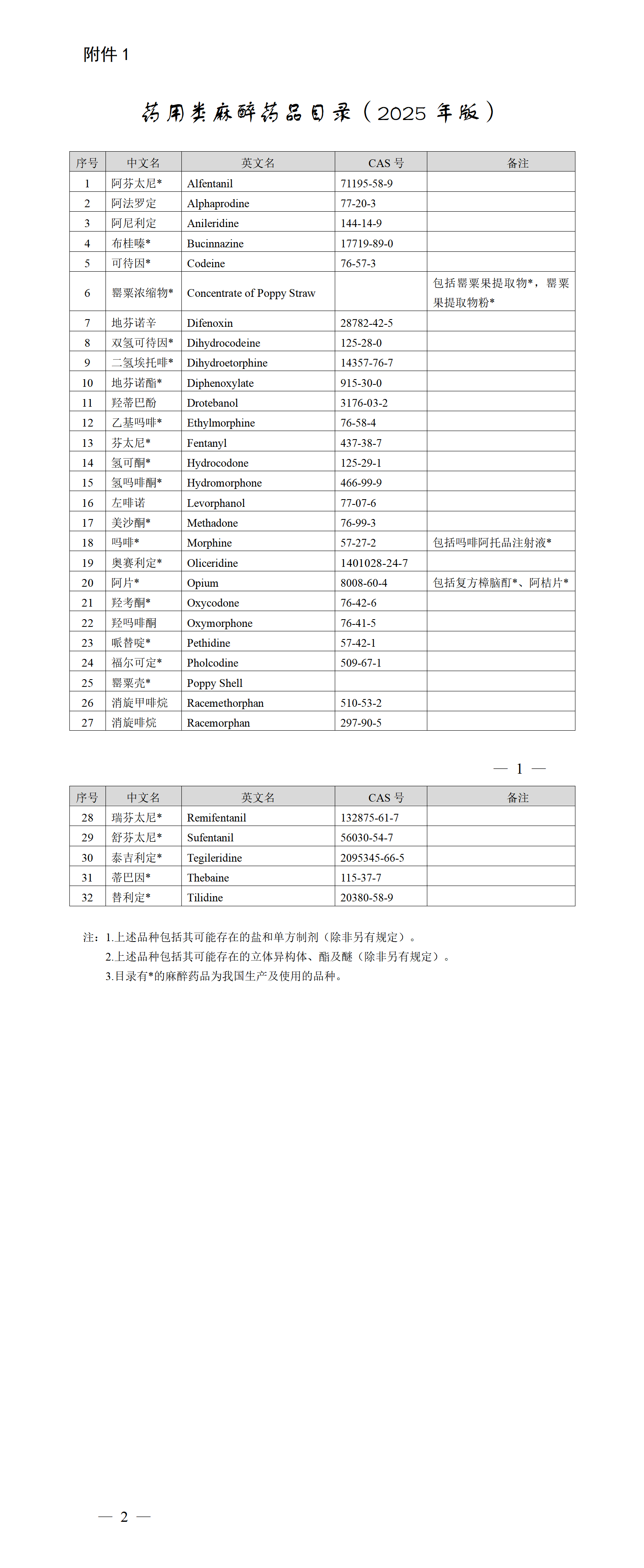
山东省药品监督管理局
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容