8月14日,CytomX Therapeutics Inc (NASDAQ:CTMX)宣布了其正在进行的CX-2051一期临床试验的最新情况。
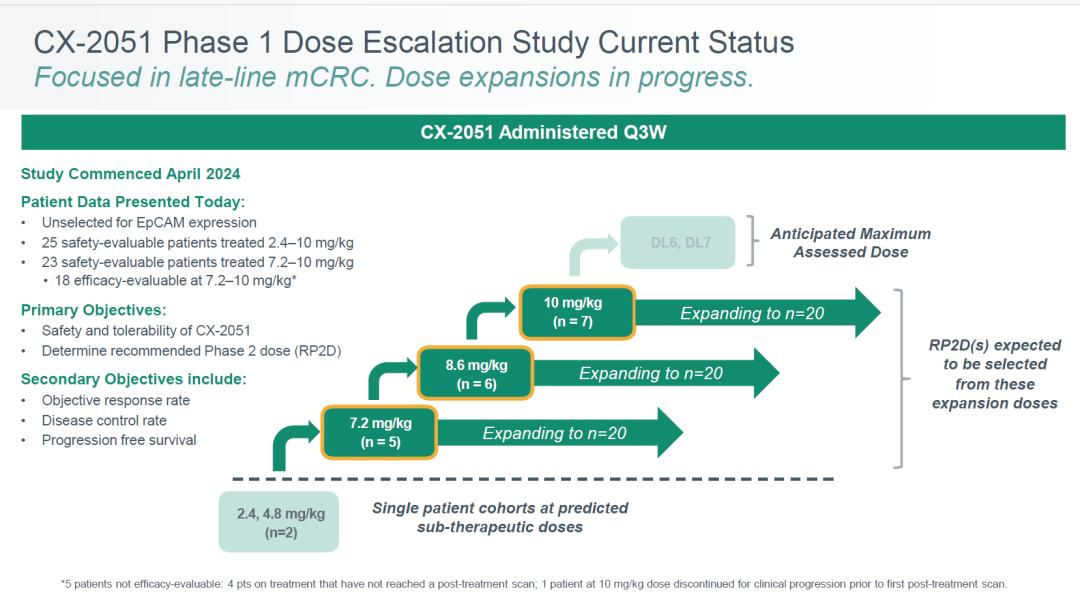
报告称在7.2 mg/kg、8.6 mg/kg和10 mg/kg剂量(每三周给药一次)的扩展队列中,每组已按计划招募了约20名患者。
根据新闻稿,一名有复杂病史(包括仅有一个肾脏)的患者出现了一例5级(死亡)治疗相关急性肾损伤。该事件被认为是继发于恶心、呕吐和腹泻,公司于7月11日收到报告。随后,CytomX Therapeutics于7月18日按照监管要求通知了美国食品药品监督管理局(FDA)。
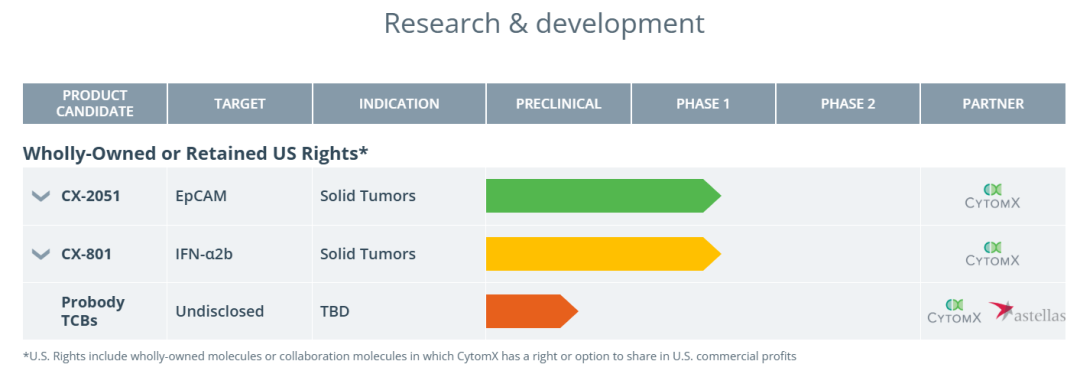
CX-2051临床设计
![]()
![]()
CTMX-2051-101安全审查委员会于7月14日召开会议,支持继续执行和招募该研究。公司表示,临床试验仍在进行中,预计将在2026年第一季度前提供一期临床数据更新。
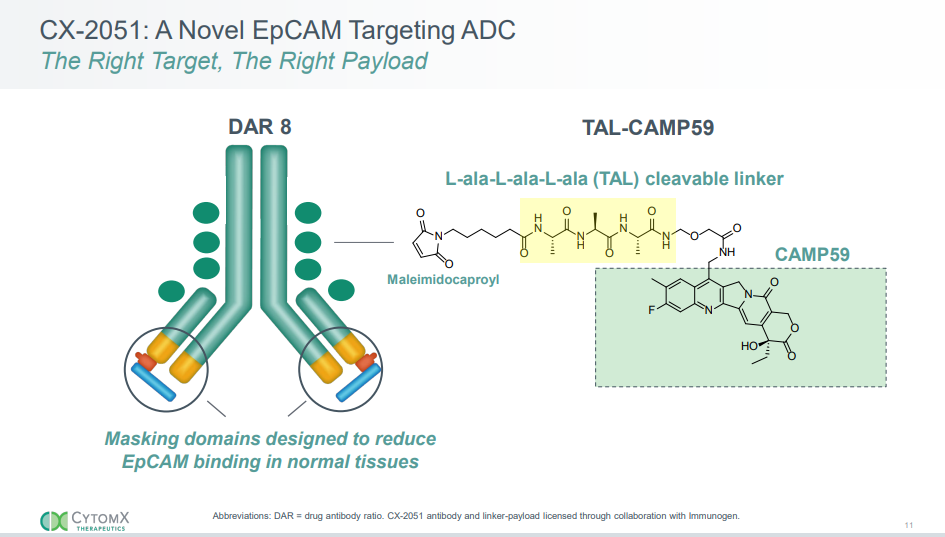
CX-2051是一款具备条件激活机制的掩蔽型ADC候选药物,靶向EpCAM(上皮细胞黏附分子)。CX-2051搭载的是一种下一代拓扑异构酶-1抑制剂载荷,具体是一种下一代喜树碱类似物偶联载荷,其连接子经过优化,旨在发挥旁观者效应。近期,公司还公布了2025年第二季度财报,Q2营业收入为1870万美元,同比下降34%,运营支出为1990万美元,同比下降69%。季度末,公司持有1.581亿美元的现金、现金等价物和投资,预计现金可支撑至2027年。CytomX是一家临床阶段,专注于肿瘤学的生物制药公司。该公司正在开发一类基于Probody®技术平台的新型研究性抗体疗法,用于治疗癌症。CytomX与AbbVie,Amgen,Astellas和Bristol Myers Squibb建立了战略药物发现和开发合作,CytomX临床阶段的管线包括针对以前无法药物靶标的潜在一流候选产品。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容