
2025-11-18 09:23:30来源:注册圈浏览量:586
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/11fc6ef8418697ad269a89937eb29b5e

为了规范和指导重组糖蛋白激素类产品的药学研究,在国家药品监督管理局的部署下,我中心组织制定了《重组糖蛋白激素类产品药学研究与评价技术指导原则》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
特此通告。
附件:重组糖蛋白激素类产品药学研究与评价技术指导原则
国家药监局药审中心
2025年10月29日

二、关于公开征求《人乳头瘤病毒疫苗临床试验技术指导原则(修订版征求意见稿)》意见的通知
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/d2d4531f341f80b74b1282c7c075eddd

《人乳头瘤病毒疫苗临床试验技术指导原则》(以下简称指导原则)于2023年发布试行。该指导原则在人乳头瘤病毒(HPV)疫苗临床研发与评价中发挥了重要作用。随着HPV疫苗临床试验数据的积累、对迭代疫苗认知的深入,以及2025年9月国家卫生健康委宣布将HPV疫苗正式纳入国家免疫规划的实际情况,有必要对试行版进行补充完善,以便更加科学合理地指导和规范后续HPV疫苗的研发。
我们诚挚地欢迎社会各界对修订版征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。
您的反馈意见请发到以下联系人的邮箱:
联系人:贾培媛、刘亚琳
联系方式:010-80995653、80995650
邮箱:jiapy@cde.org.cn、liuyalin@cde.org.cn
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2025年11月10日

三、关于再次公开征求《流感病毒疫苗临床试验技术指导原则(征求意见稿)》意见的通知
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/3c83886fde908b6119f925e216e71693

为指导和规范我国流感病毒疫苗的临床研发,我中心曾组织起草了《季节性流感病毒疫苗临床研究技术指导原则》,并公开征求意见。随着近年来新技术路线的发展、病毒流行趋势的变化以及研究数据的积累等,为更加全面、科学地指导我国流感疫苗研发上市,我中心对该指导原则进行了修订完善,形成了征求意见稿,名称修改为《流感病毒疫苗临床试验技术指导原则》,现再次公开征求意见。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。
您的反馈意见请发到以下联系人的邮箱:
联系人:刘波,潘阳,苏瑶
联系方式:liub@cde.org.cn,pany@cde.org.cn,suy@cde.org.cn
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2025年11月10日
四、关于公开征求《重组表达单克隆抗体类生物制品制造及检定规程撰写指南(征求意见稿)》意见的通知
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/669b709bdd86f18e06732111f00a7a8d

近年来,重组表达单克隆抗体类生物制品注册上市申报品种数量以及获批上市数量显著增长。针对重组表达单克隆抗体类产品制定具体的撰写指南,将有助于申请人更清晰、高效地完成《制造及检定规程》的修订,从而加快整体审评进度。为进一步明确重组表达单克隆抗体类生物制品制造及检定规程撰写中的要点,提高药品审评审批质效,促进药品研发注册进程,我中心组织起草了《重组表达单克隆抗体类生物制品制造及检定规程撰写指南(征求意见稿)》。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起一个月。
您的反馈意见请发到以下联系人的邮箱:
联系人:武勇凯
联系方式: wuyk@cde.org.cn
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2025年11月10日

五、关于公开征求《中药提取物质量控制研究技术指导原则(征求意见稿)》意见的通知
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/17ae39177d64eca3ea29b8091e49e9bc

为促进中药新药研发守正创新,指导申请人开展中药创新药1.2类(从单一植物、动物、矿物等物质中提取得到的提取物及其制剂)的研发,药品审评中心组织起草了《中药提取物质量控制研究技术指导原则(征求意见稿)》。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。
您的反馈意见请发到以下联系人的邮箱:
联系人:中药民族药药学部
联系方式:zyyxzdyz@cde.org.cn(邮箱名为“中药药学指导原则”拼音首字母),邮件标题请标注“中药提取物”。
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2025年11月13日
六、关于将Vorasidenib片纳入《儿童抗肿瘤药物研发鼓励试点计划(星光计划)》试点项目的公示
网址:
https://www.cde.org.cn/main/news/viewInfoCommon/951c0267f49c8e91e5f4ba764d77436f
依据《儿童抗肿瘤药物研发鼓励试点计划(星光计划)申报指南》,现将拟纳入“星光计划”试点项目的基本信息予以公示,公示时间截至2025年11月20日。
品种名称:Vorasidenib片
申报单位:施维雅(天津)制药有限公司
拟开发儿童适应症:易感IDH1或IDH2突变的2级星形细胞瘤或少突神经胶质瘤
如有异议,请将具体意见发送至邮箱:etdrugs@cde.org.cn。
https://www.nmpa.gov.cn/xxgk/ggtg/zhggtg/20251110171700138.html

为进一步做好易制毒化学品出口管理工作,根据《向特定国家(地区)出口易制毒化学品暂行管理规定》,商务部、公安部、应急管理部、海关总署和国家药监局决定对《向特定国家(地区)出口易制毒化学品管理目录》《特定国家(地区)目录》进行调整,将美国、墨西哥、加拿大增列入《特定国家(地区)目录》,并单独增列针对上述3个国家的13种易制毒化学品。
现将调整后的《向特定国家(地区)出口易制毒化学品管理目录》和《特定国家(地区)目录》予以公布。自本公告发布之日起,向美国、墨西哥、加拿大出口附件1第一部分所列化学品的,应按照《向特定国家(地区)出口易制毒化学品暂行管理规定》申请许可,向其他国家(地区)出口无需申请许可。
附件:1.向特定国家(地区)出口易制毒化学品管理目录
2.特定国家(地区)目录
商务部
公安部
应急管理部
海关总署
国家药监局
2025年11月10日
https://www.nmpa.gov.cn/xxgk/ggtg/zhggtg/20251110172137174.html

为依法加强对制毒物品的管控,国家禁毒委员会办公室11月10日向全社会发布《国家禁毒委员会办公室关于防范制毒物品和非列管可制毒化学品及设备流失的通告》。
《通告》共十三条,涉及《中华人民共和国刑法》《中华人民共和国禁毒法》《中华人民共和国海关法》《易制毒化学品管理条例》等法律法规对制毒物品犯罪、制毒共犯、偷逃税款犯罪、走私犯罪、网络信息发布以及反洗钱和外汇管理相关规定,以及针对邮政企业、快递企业、物流企业、国际货运代理企业及其他单位和个人关于防范制毒物品相关违法犯罪的要求,以提醒相关企业和个人在从事经营活动时遵守国家相关法律法规,防范境外法律风险,维护我国企业和公民合法权益。
国家禁毒委员会办公室通告
为进一步规范制毒物品和非列管可制毒化学品及设备的生产、经营、运输和进出口活动,防范流入非法渠道,被不法分子用于从事违法犯罪活动,保护我国企业和公民的合法权益,维护国家经济安全和社会稳定,根据《中华人民共和国刑法》《中华人民共和国禁毒法》《中华人民共和国海关法》《中华人民共和国邮政法》《中华人民共和国网络安全法》《中华人民共和国广告法》《中华人民共和国出口管制法》《中华人民共和国税收征收管理法》《中华人民共和国反洗钱法》《易制毒化学品管理条例》《危险化学品安全管理条例》《中华人民共和国外汇管理条例》等法律法规,现就有关事项通告如下:
一、根据《中华人民共和国刑法》规定,严禁任何组织和个人非法生产、买卖、运输醋酸酐、乙醚、三氯甲烷或其他用于制造毒品的原料、配剂,或者携带上述物品进出境。严禁任何组织和个人明知他人制造毒品而为其生产、买卖、运输前款规定的物品。
二、根据《中华人民共和国刑法》规定,明知他人将使用某种非列管可制毒化学品及设备非法制造毒品,而仍然为其生产、销售、运输或进出口非列管可制毒化学品及设备的,按照制造毒品犯罪共犯论处。
三、根据《中华人民共和国刑法》《中华人民共和国税收征收管理法》相关规定,生产、销售非列管可制毒化学品及设备的企业应依法履行纳税义务,通过欺骗、隐瞒等手段偷逃税款的,将由税务机关进行追缴,构成犯罪的,将依法追究刑事责任。
四、违反《中华人民共和国海关法》及有关法律、行政法规,逃避海关监管,偷逃应纳税款、逃避国家有关进出境的禁止性或者限制性管理,运输、携带、邮寄国家禁止或者限制进出境货物、物品或者依法应当缴纳税款的货物、物品进出境的,是走私行为,由海关没收走私货物、物品及其违法所得,可以并处罚款,构成犯罪的,依法追究刑事责任;进出口货物、物品或者过境、转运货物向海关申报不实的,可以处以罚款,有违法所得的,没收违法所得。
五、根据《中华人民共和国网络安全法》规定,网络运营者应当加强对其用户发布的信息的管理,发现法律、行政法规禁止发布或者传输的信息的,应当立即停止传输该信息,采取消除等处置措施,防止信息扩散,保存有关记录,并向有关主管部门报告。
六、根据《中华人民共和国刑法》《中华人民共和国反洗钱法》《中华人民共和国外汇管理条例》等相关规定,生产、销售非列管可制毒化学品及设备的企业或个人应遵守反洗钱、外汇管理等相关规定。从事非法跨境转移资金活动的,将由有关主管部门依法予以行政处罚,构成犯罪的,将依法追究刑事责任。
七、鼓励生产、销售、运输或进出口非列管可制毒化学品及设备的单位,建立健全内部管理制度,保存相关记录以及相关许可证复印件或者证明文件,特别是严格审核境外买家资质,警惕其以“高额订单”“样品测试”为名诱导违规交易。如发现下游买家要求变更可制毒化学品的名称、包装、运输方式等可能将其用于非法用途线索,或发现存在虚开发票、伪报信息等违法犯罪嫌疑的,请立即停止交易,依法向属地公安机关或有关主管部门报告,并配合查清事实,避免卷入违法犯罪活动。
八、任何单位在互联网上发布非药品类易制毒化学品销售信息,应当具有工商营业执照、非药品类易制毒化学品生产、经营许可证或备案证明等资质材料;禁止个人在互联网上发布非药品类易制毒化学品销售信息。禁止任何单位和个人在互联网上发布药品类易制毒化学品广告信息。任何单位及个人在互联网、社交媒体、电商平台等渠道发布非列管可制毒化学品及设备的销售信息时,应当实名登记,遵守相关法律法规,严禁发布违法信息。通过境外平台发布此类信息时,还应遵守相关国家法律法规。
九、请相关单位和个人增强法律意识,对既有合法用途又可用于制毒的非列管可制毒化学品及设备,出口时应密切关注国际公约、相关进口国特别是美国、加拿大和墨西哥等高风险国家的法律法规,要求境外客户根据其本国法律法规履行进口法律程序,防范法律风险。
十、请相关单位和个人增强风险意识,明知某种非列管可制毒化学品及设备已被有关国家管制,未按照进口国相关法律法规要求向该国销售、运输、出口的,将可能面临该国执法部门的刑事指控或制裁。
十一、邮政企业、快递企业和物流企业发现以夹藏夹带、伪报品名等形式向境内外非法寄递、运输易制毒化学品等制毒原料或配剂的,请依法立即向公安机关或者海关报告,并配合公安机关或者海关进行调查。邮政企业、快递企业和物流企业应当如实记录或者保存上述信息。
十二、国际货运代理企业应如实申报货物名称及用途等,与走私人通谋为其走私非列管可制毒化学品或设备提供运输、保管、邮寄或者其他方便的,将被依法追究法律责任。
十三、相关单位和个人如遇外国执法部门违法行使职权,可充分运用法律手段维护自身安全与合法权益,向中国驻外使领馆寻求协助。
特此通告。
https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxpzhzhcchpgg/20251111111039148.html
特此公告。
附件:2025年10月批准注册医疗器械产品目录
国家药监局
2025年11月7日
https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/zhybhpzh/zhybhpzhgg/20251112164642166.html
根据《中药品种保护条例》第十六条及有关规定,经国家中药品种保护审评委员会组织的委员审评,国家药监局核准:
对上海黄海制药有限责任公司的扶正化瘀胶囊继续给予二级保护,其保护期限、保护品种编号分别为:2025年11月10日—2030年7月20日、ZYB20720250300。
特此公告。
国家药监局
2025年11月10日
https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20251114111532127.html
日前,国家药监局、公安部和国家卫生健康委联合发布药用类麻醉药品和精神药品目录公告。根据《中华人民共和国药品管理法》《中华人民共和国海关法》等法律法规规定,现公布供通关申报参考的药用类麻醉药品和精神药品海关商品编号。有关商品编号仅包含管制商品中的部分商品。如实际进出口商品超出相关商品编号范围,应当如实申报。本公告自2025年11月15日起施行。
特此公告。
附件:1.药用类麻醉药品海关商品编号
2.药用类精神药品海关商品编号
国家药监局 海关总署
2025年11月3日
https://www.nmpa.gov.cn/xxgk/ggtg/hzhpggtg/hzhpchjgg/hzhpcjgjj/20251114180134122.html

根据《化妆品监督管理条例》《化妆品生产经营监督管理办法》《化妆品抽样检验管理办法》,国家药品监督管理局已要求北京、辽宁、上海、浙江、福建、河南、湖南、广东、四川等省(市)药品监督管理部门对上述不符合规定化妆品涉及的注册人、备案人、受托生产企业等依法立案调查,责令相关企业依法采取风险控制措施并开展自查整改。各省(区、市)药品监督管理部门要依法责令相关化妆品经营者停止经营上述化妆品,并依法调查其进货查验记录等情况,对违法产品进行追根溯源,发现违法行为的,依法严肃查处;涉嫌犯罪的,依法移送公安机关。
特此通告。
附件:48批次不符合规定化妆品信息
国家药监局
2025年11月14日


https://yjj.sh.gov.cn/zxyp/20251111/4c10636f292a4d6c9dbbebd06c83a7d8.html

机关各处、稽查局、药审中心:
《上海市药品现代物流指导意见》已经市药品监督管理局2025年10月30日第19次局长办公会审议通过,现印发给你们,请遵照执行。
特此通知。
上海市药品监督管理局
2025年11月7日
https://yjj.sh.gov.cn/zcjd/20251111/a8946b2ad40d4f54bc93e2452ba3b805.html
一、《意见》的制定的目的和意义是什么?
优化药品流通行业布局,深化药品流通领域物流基础设施网络建设是国家关于药品流通的规划和政策导向。随着《药品经营和使用质量监督管理办法》的贯彻实施,开办批发企业应当具备现代物流设施设备已成为明确的许可要求,多个外省市药监部门制修订省级药品现代物流指导文件,规范药品批发企业准入、推进辖区内企业转型升级。同时,出于降本增效、转型发展的需求,近年来行业积极探索多仓协同、批零一体等新的经营模式,国务院办公厅《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》《上海市药品和医疗器械管理条例》也有相关明确表述。为细化和规范有关监管要求,顺应上海市生物医药产业整体布局规划,引导、推动和规范药品批发企业的高质量发展,在参考外省市标准并充分考虑本市行业实际的基础上,经过通盘考虑、整体设计,修订《上海市药品现代物流指导意见》(以下简称《意见》)。
二、《意见》的制定依据是什么?
《中华人民共和国药品管理法》(中华人民共和国主席令第31号)《中华人民共和国疫苗管理法》(中华人民共和国主席令第30号)《上海市药品和医疗器械管理条例》(2024年12月31日上海市第十六届人民代表大会常务委员会第十八次会议通过)《药品经营和使用质量监督管理办法》(市场监管总局令第84号)《药品经营质量管理规范》(原食药监总局令第28号)《关于进一步做好药品经营监督管理有关工作的公告》(国家药监局公告2024年第48号)《关于修订印发<药品经营质量管理规范现场检查指导原则>有关事宜的通知》(食药监药化监〔2016〕160号)。
三、哪些企业需要符合《意见》的要求?
本市新开办的药品批发企业和开展受托储存、运输药品业务的药品批发企业,应当符合本意见要求。
其中新开办的药品批发企业应当符合第一章至第五章的要求;开展受托储存、运输药品业务的药品批发企业还应当符合第六章的要求,即符合更高的要求,具体表现在要求其具有更多的仓储面积或容积以及运输车辆,增加电子数据交换平台配置,相关质量管理制度和记录的建立以及委托协议的要求,确保发挥企业物流专业的优势的同时,保障药品储存、运输、配送过程中的质量安全。
同一法人主体开展药品批发和零售连锁一体化经营的,既要符合本意见关于批发企业的要求,也要符合《上海市药品零售企业许可验收实施细则》关于零售连锁总部的要求。
对于本市已开办的未达到药品现代物流要求的药品批发企业,可以通过逐步提高现代物流条件或者委托符合条件的企业储存、运输来实现药品现代物流管理要求。
四、药品仓储建筑是否必须是自有房产?
药品仓储建筑可以为自有或租赁。企业应当评估所使用的建筑是否可满足配备《意见》所要求设施设备的要求。
五、新开办药品批发企业、开展受托储存、运输药品业务的药品批发企业、生物制品和药品类诊断试剂的专营批发企业,药品经营批发仓储面积或容积以及运输车辆的要求分别是什么?
新开办药品批发企业,其仓库储存区整体建筑面积不少于10000平方米或容积不少于50000立方米。开展冷链药品物流业务的,应当配备2个(含2个)以上独立冷库(柜),总容积不少于500立方米。开展冷链药品物流业务的,应当配备冷藏车。
开展受托储存、运输药品业务的药品批发企业,其仓库储存区整体建筑面积不少于15000平方米或容积不少于75000立方米。开展冷链药品物流业务的,应当配备2个(含2个)以上独立冷库(柜),总容积不少于1000立方米。应当配备与药品配送规模相适应的密闭式自有运输车辆不少于8辆,开展冷链药品物流业务的,还应当配备不少于3辆冷藏车。
专营生物制品的药品批发企业,其仓库整体建筑面积不少于3000平方米或容积不少于10000立方米。应当配备2个(含2个)以上独立冷库(柜),总容积不少于1000立方米。如果经营特殊储存温度要求的药品,还需配备与经营品种和规模相适应的仓库和设施。开展冷链药品物流业务应当配备冷藏车。
药品类诊断试剂专营企业,其仓库面积不少于60平方米,含冷链药品业务的冷库容积不少于20立方米,含冷链药品业务的需要配备冷藏车。
六、企业应当配备哪些仓库设施设备?
企业应当配备可以实现与药品入库、验收、传送、上架、分拣、出库、复核、集货等现代物流作业需求相匹配的设施、设备,主要包括以下几个方面:
(一)入库管理设备。在仓储管理系统(WMS)的协同控制下,根据面积、储存方式、距离等要素,采用适宜设备如动力输送线、巷道堆垛机、自动导向搬运车(AGV)、穿梭车、必要时辅助用的电动叉车等)实现货位自动分配、自动识别、自动寻址和搬运功能。
(二)存储设备。可选择性配备托盘、隔板货架、流利式货架、高位货架或自动化仓库等,货位之间、药品与地面、墙壁之间应有效隔离。托盘、货架标识条形码实行货位管理,一位一码,由仓储管理系统(WMS)统一控制、管理、调度。
(三)库内输送设备。配备与物流规模相适应的设施设备(如动力输送线、巷道堆垛机、自动导向搬运车(AGV)、穿梭车、必要时辅助用的电动叉车等),可以覆盖储存区、拣选作业区、出库复核区、集货配送区等区域,实现物流作业的精准连贯,防控混淆、差错风险。
(四)信息识别管理设备,采用条型码编制/打印扫描设备、射频技术(RF)、电子标签辅助拣货系统(DPS)等设备。
(五)温湿度调控设备。配备符合相关环境指标要求的中央空调系统等可以调控库房温湿度及进行库房室内外空气交换的设备。
(六)供电设备。配备双回路供电系统或者备用发电机组等,备用发电机组功率应当至少能够保障药品仓储作业区域的照明,确保冷库设备、温湿度监控设备、计算机控制室(区)及服务器数据中心可以正常运行。
七、企业的信息管理设备包括哪些?具备什么功能?
企业信息管理系统应当包括企业资源计划管理系统(ERP)、仓储管理系统(WMS)、设备控制系统(WCS)、运输管理系统(TMS)、温湿度自动监测系统、药品追溯系统等。企业应当通过信息化手段实现各系统之间的数据实时对接、交互、可追溯,具体要求如下:
(一)企业资源计划管理系统(ERP)应当覆盖药品经营、物流质量管理全过程。
(二)仓储管理系统(WMS)应当与企业资源计划管理系统(ERP)、设备控制系统(WCS)、运输管理系统(TMS)等数据进行实时、准确对接,实现药品入库、储存、养护、盘点、出库、退货、运输等仓储、物流全过程质量管理和控制,并实现全程货物查询和追踪功能。
(三)设备控制系统(WCS)应当实现仓储各作业环节自动、连续的物流传送,所属设施设备应当与仓储管理系统实时数据对接。
(四)运输管理系统(TMS)应当具备对药品运输全过程进行跟踪、记录、调度的功能。
(五)温湿度自动监测系统应当对仓库温湿度及冷藏、冷冻药品运输温度开展实时监测及记录。
(六)药品追溯系统应当实现药品各级包装单元的追溯、可核查
(七)各类信息管理系统的数据录入、采集、交换、修改和保存应当确保真实、准确、完整、安全和可追溯。
八、多仓协同主体方的基本条件是什么?
多仓协同本质是若干个批发企业共享人员、信息、仓储、运输等资源,开展跨区域药品物流活动,因此位于本市的多仓协同主体方企业应当符合药品批发企业现代物流基本要求,承担多仓协同管理核心职责。利用多仓协同模式开展受托储存药品业务的,主体方还应符合开展受托储存、运输药品业务的药品批发企业的要求。
九、开展批零一体经营的质量管理人员和相关部门是否可以合并?
可以由同一质量负责人全面负责药品批发和零售连锁总部质量管理工作,但应分别设置批发和零售连锁质量管理部门并分别配备质量管理部门负责人,具体负责药品批发和零售连锁质量管理工作。药品由负责批发经营的部门统一开展采购。
十、《意见》的实施期限是如何规定的?
《意见》是药品批发企业许可的审批依据,根据有关规定,本《意见》自2025年11月7日起实施,有效期5年,至2030年11月6日止。
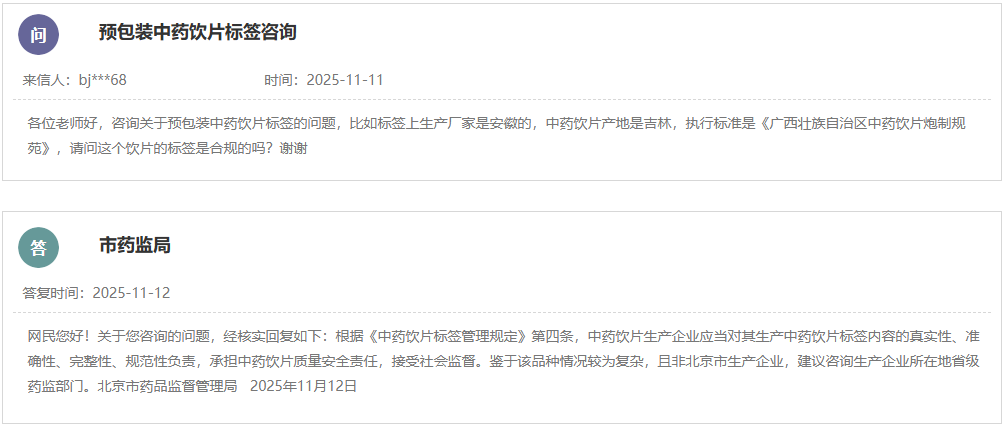
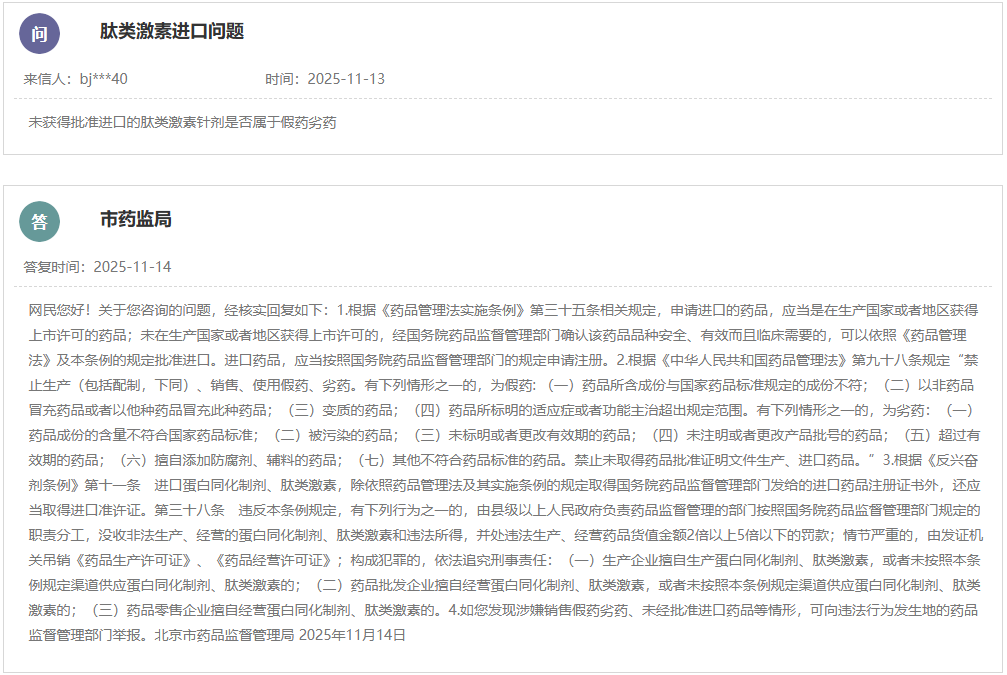
https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/xx-yjj.html

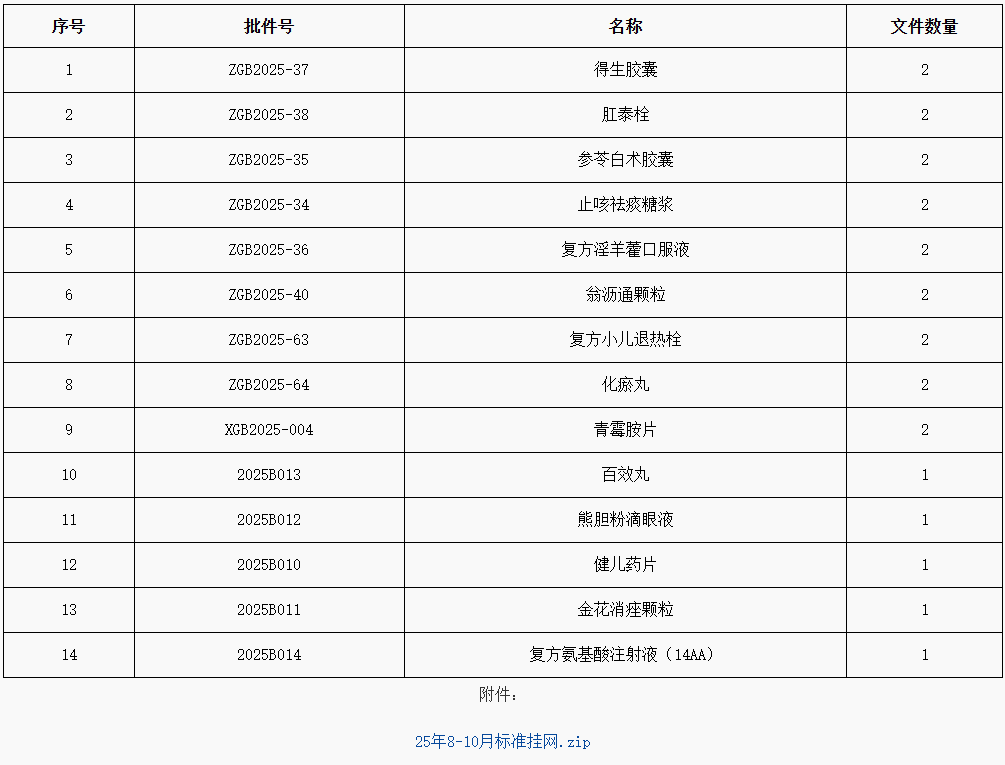
(一)国家药品标准颁布件(202508-10)
网址:
http://mpa.gd.gov.cn/zwgk/jgsz/zcc/zlbzj/content/post_4797876.html

声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容