
2021-09-28 15:27:26来源:同写意浏览量:1369
导读:科学的监管离不开统计学。
统计学为循证医学证据的萃取做出了重要贡献,没有统计学参与,临床治疗可能还停留于望、闻、问、切形而之下的经验医学模式。
生物统计人员不仅要有良好的统计学基础和一定的医学知识,还要有良好的科研素质,和临床医师共同营造“数据证据+医师经验+患者配合”三位一体的循证医学模式。
——夏结来
01
科学的监管离不开统计学
1、统计学是监管的重要工具
不管是药物研发,还是监管体系的打造,统计学都非常重要。科学的监管离不开统计学。药物研发的监管是依法依规的,上位法是《药品管理法》,指导原则是依法制定的规矩,遵循指导原则就是按照规矩办事。
以临床价值为导向的肿瘤药物研发会脱离实际吗?当然不会,相反会促进创新。创新就一定是firstinclass吗?这样理解是错误的。
举例来讲,如果能研制出28纳米的芯片,就不会被国外“卡脖子”。虽然研制28纳米的芯片不算创新,只是MeToo,但把仿制药品做到全世界顶尖,也是国家实力的体现。所以应该强调脚踏实地的创新,采用科学的方法来监管药物研发全过程。
统计学是监管的一个重要工具,用于保证上市药物或器械的有效性和安全性。从关键质量参数,到临床前的动物实验;从早期临床试验,到II、III期试验再到药物上市,整个过程都离不开统计学。如果统计学“缺席”,药物研发进程大概率会滞后,还会在黑夜里摸索很多年,统计的重要性不言而喻。
统计学是药物研发中的重要环节。为什么需要统计学?医学研究的对象是随机现象,需要统计学来分析处理。统计学是医学交流的一种语言,能使研究者透过现象看清本质,从数据变化中寻找规律。所以,研究的各个阶段都离不开统计学的支撑。
2、统计学是安全性和有效性的保证
药品或医疗器械的安全性和有效性必须经过临床实验的安全验证。为了保障人民的健康,我国以主权的形式,对药物上市进行强制监管。ICH组织和多个国家都分别制定了一系列临床研究指导原则和规范。
“在整个临床研究的过程中,对安全性和有效性的验证,都要用到统计学。而临床研究的拓扑关系中,涉及到主要研究者、监管机构、统计方、数据管理方、申办方、受试者、临床监查方,在这复杂的关系中最不能忽视的就是受试者,没有受试者,又何谈临床研究?”
在沙特、东南亚等多个国家有四五万名受试者参加新冠疫苗的临床研究。没有受试者的奉献精神,很多药是研发不出来的,药物的成功研发和受试者有很大的关系,特别是肿瘤药物。有句话叫“一药功成万骨枯”,受试者承受了莫大的期望与失望,许多参与试验的肿瘤患者不幸离世,经治疗成功存活的是少数。应向那些离去的志哀,应向他们表达谢意。
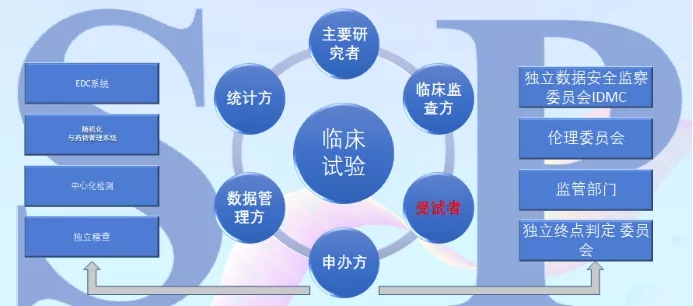
临床拓扑关系图
我国监管机构要求临床试验成立独立的数据安全监查委员会(DSMB),例如新冠疫苗的临床试验中都成立了DSMB,我参与了其中的大部分。美国FDA有庞大的生物统计学审评队伍,基本都是统计学博士,CDER有260名左右,CBER有60名左右,CDRH有100名左右。
欧盟、日本、韩国、我国的台湾省等监管部门也都有大量的生物统计审评专家。欧美有庞大的生物统计监管体系,与之相比我国的统计审评队伍还在发展阶段。目前CDE、CMDE也配备了生物统计学审评专家,队伍在逐步发展,审评水平也在逐步提高,希望最终能建立起与欧美国家水平相当的监管队伍以适应我国药物或器械创新研发的需求。
02
研究方案设计需要统计学
1、监管的科学性
监管的作用如何体现呢?所谓科学监管就是让假药或劣药的比例控制在可接受的范围内。我国目前的标准是最多能容忍100个上市药物中有2.5个假/劣药。美国对常规药物,比如内分泌治疗药物、心血管治疗药物要求假/劣药的比例控制在万分之6.25以内,即1万个上市药物里,最多有6.25个假/劣药。这是因为美国的常规药要求两个临床研究相互支撑。
但去年美国FDA批准上市的治疗老年痴呆的药物,两个试验中有一个临床终点并没有达标,是通过临床药理学一系列模型拟合“操作”后批准上市了,也许是出于未被满足的医学需求的考虑吧。最近FDA把该药的适应症缩窄到轻型老年痴呆,不再适用于所有类型老年痴呆病人。由此外界对该药的获批也产生了质疑,前两天美国药监局局长,恳请美国检察长前来调查该药在审评审批过程FDA是否存在不当行为。
“监管的目的,就是把市场上的假/劣药控制在一个可接受的范围内。如果监管不力,就会有大量的假药/劣药在市场上流通的可能,在现行医疗体制下靠市场淘汰假/劣药还是十分困难的。”
监管要求假阳性率(falsepositiverate)、假阴性率(falsenegativerate)处于较低的水平。目前我国的药物审批采取了终身责任制,一旦批了假药,后期被查出,审批人员要担责,这就是审批风险。虽然审批风险使得审评专家在审评审批时心生敬畏,但事实上无论监管多严格都不能完全避免假阳性。
假阳性是消费者风险,也叫患者风险、审批风险。法规层面解释:如果一个确证性试验在单侧α=0.025水平得出某干预是有效的即被批准上市,这个药实际无效的风险最高为2.5%。统计规律是不可逾越的,如果非要把那个碰到了2.5%的倒霉蛋抓起来坐牢那也太武断了。所以要科学的监管。
2、偏倚来源和医学比较类型
临床研究过程中常存在三种偏倚来源(偏倚:研究结果与真实结果的差异):选择性偏倚、信息偏倚、混杂偏倚。要通过科学的统计设计来尽可能的减小偏倚对结果的影响,如采用随机分组、设置合理的对照、盲法等。
试验设计方法在不断的发展,设计越来越弹性化。从最开始传统的试验设计方法到成组序贯设计,再到适应性设计。国家也出台多项指导原则,以期缩短研究时间,着力于创新。
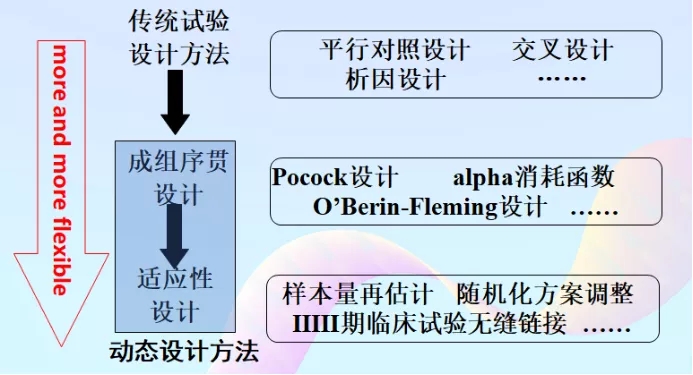
试验设计方法的发展
现在强调以临床价值为导向,试验过程中尽可能采用盲法,尽可能依从方案。但并不排斥安慰剂对照的临床试验。FIC肿瘤药物的临床研究往往应从末线做起,没有阳性对照,只能采用安慰剂对照。当然不可能直接就拿一线治疗药物做对照。以临床价值为导向的指导原则没有任何问题,但市场反应很大,这就暴露出了许多伪创新的存在不是“空穴来风”。
“在创新的大环境下,仿制药厂步履维艰,勉强活下来的也有可能要偷工减料,这个一定要提前预防。毕竟当下创新药物还难以担起治病救人的大任,没有了高质量的仿制药,如果进口药“断供”,我们拿什么治病救人?”
临床研究以临床价值为导向,一般是优效(Superiority,单侧检验)、等效(Equivalence,双单侧检验)和非劣效(Non-inferiority,单侧检验)。仑伐替尼没有做优于索拉非尼的设计,选择跟索拉非尼共生,做了非劣效设计,上限设为1.08,结果仑伐替尼成功“上岸”,那个非要做优效于索拉非尼的药物却“陨落”了。
03
结语
上医治未病,如预防性疫苗;中医治欲病,如早诊早治;下医才治已病,但晚期的肿瘤患者挽救的希望微乎其微了。应重视统计学在临床研究中的应用,助力药物临床试验,持续国家数据建设,有效利用临床大数据,为“健康2030”做贡献。
声明:本文系药方舟转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!