2026-01-27 09:18:40来源:注册圈浏览量:18
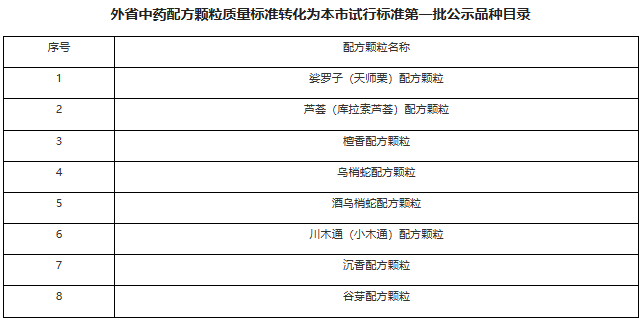
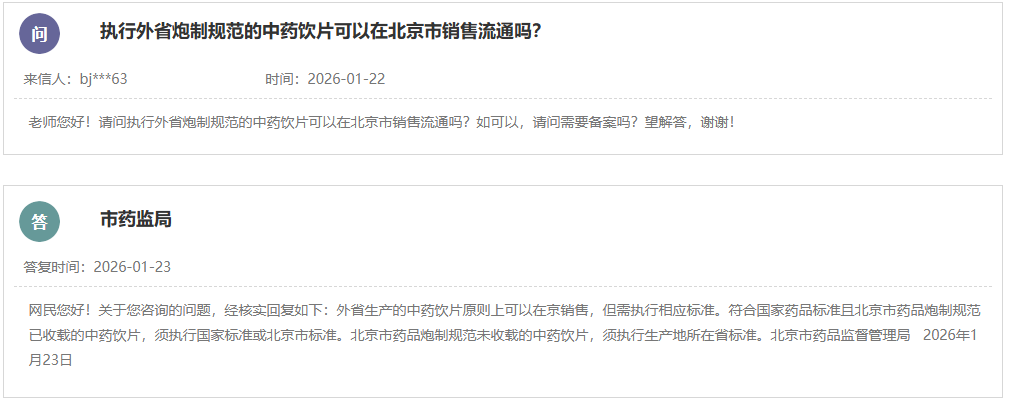
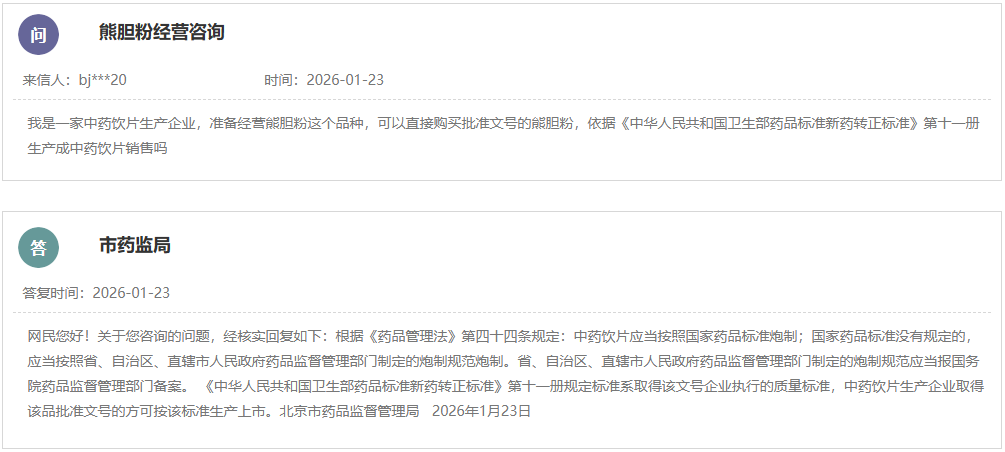
https://www.cde.org.cn/main/news/viewInfoCommon/1b87c172f248c6eb876ea2b9d93c4d1e 在临床试验中,贝叶斯方法可以高效地利用已有信息,对于提高药物研发效率和缩短研发周期具有重要作用和意义。为进一步推进贝叶斯统计作为新工具、新方法的落地实施,规范贝叶斯外部信息借用方法在临床研究中应用的技术要求,在国家药品监督管理局的部署下,药审中心组织制定了《药物临床试验中应用贝叶斯外部信息借用方法的指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。 特此通告。 附件:药物临床试验中应用贝叶斯外部信息借用方法的指导原则(试行) 国家药监局药审中心 2026年1月20日 https://www.cde.org.cn/main/news/viewInfoCommon/c21b81148b9b7908d172f97bf467d133 为鼓励疫苗的发展与创新,规范并指导预防用含佐剂疫苗研发,我中心组织制定了《预防用疫苗佐剂药学研究技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。 特此通告。 附件:预防用疫苗佐剂药学研究技术指导原则(试行) 国家药监局药审中心 2026年1月21日 https://www.cde.org.cn/main/news/viewInfoCommon/ac589f93f46056151fdf1b037788f4ad 为进一步提高化学药物残留溶剂的研究和监管水平,药审中心结合相应技术指导原则要点与审评实践,组织起草了《化学药物残留溶剂的风险评估和控制的共性问题(征求意见稿)》,现公开征求意见。 欢迎各界提出宝贵意见和建议,并请及时反馈给我们。征求意见时限为自发布之日起1个月。 请将反馈意见发到以下联系人的邮箱: 联系人:王少戎;武红娜 邮箱:wangshr@cde.org.cn; wuhn@cde.org.cn 感谢您的参与和大力支持。 国家药品监督管理局药品审评中心 2026年1月22日 https://www.cde.org.cn/main/news/viewInfoCommon/27cae5f5c6ee99cacdf0d86bc4bdb06b 依据《儿童抗肿瘤药物研发鼓励试点计划(星光计划)申报指南》,现将拟纳入“星光计划”试点项目的基本信息予以公示,公示时间截至2026年01月29日。 申报单位:华润三九医药股份有限公司 拟开发儿童适应症:经标准治疗后复发/进展H3K27m突变型弥漫性中线胶质瘤儿童患者(6至<18岁) 如有异议,请将具体意见发送至邮箱:etdrugs@cde.org.cn。 网址: https://www.cde.org.cn/main/news/viewInfoCommon/3dda22a2276c2601a3c797f7800ecf24 依据《儿童抗肿瘤药物研发鼓励试点计划(星光计划)申报指南》,现将拟纳入“星光计划”试点项目的基本信息予以公示,公示时间截至2026年01月29日。 品种名称:盐酸匹米替尼胶囊 申报单位:默克雪兰诺(北京)医药有限公司 拟开发儿童适应症:需要系统性治疗的腱鞘巨细胞瘤(TGCT)/色素沉着绒毛结节性滑膜炎(PVNS)青少年患者(12岁至<18岁,体重≥40 kg) 如有异议,请将具体意见发送至邮箱:etdrugs@cde.org.cn。 https://www.cde.org.cn/main/news/viewInfoCommon/3c3ef49a5ab316a8d6ca95850b325dbb 依据《儿童抗肿瘤药物研发鼓励试点计划(星光计划)申报指南》,现将拟纳入“星光计划”试点项目的基本信息予以公示,公示时间截至2026年01月29日。 品种名称:依维莫司微片 申报单位:杭州煌森生物科技有限公司 拟开发儿童适应症:手术风险极大/无法手术或无其他确切的治疗方案的节细胞神经母细胞瘤(GNB)或节细胞神经瘤(GN)儿童患者 如有异议,请将具体意见发送至邮箱:etdrugs@cde.org.cn。 https://www.cde.org.cn/main/news/viewInfoCommon/9a9c3213a4f44e502bf7b18bbe93333d ICH《E22:患者偏好研究的一般考虑》指导原则草案现进入第3阶段区域公开征求意见阶段。按照ICH相关章程要求,ICH的监管机构成员需收集本地区关于该文件草案的意见并反馈ICH。 E22指导原则草案的英文原文和中文译文见附件,现就该指导原则内容及中文译文向社会公开征求意见。 社会各界如有相关建议,请于2026年4月6日前通过电子邮箱反馈我中心。 邮箱:gkzhqyj@cde.org.cn 附件:1.《E22:患者偏好研究的一般考虑》草案英文版 2.《E22:患者偏好研究的一般考虑》草案中文版 3.征求意见反馈表 国家药品监督管理局药品审评中心 2026年1月23日 https://www.cde.org.cn/main/news/viewInfoCommon/38c7c506185f3f4090ff07f8934e835b 为明确局部给药局部起效化学仿制药物理化学及结构(Q3)特性研究的技术要求,更好地指导企业进行研究以及统一监管要求,我中心组织起草了《局部起效化学仿制药物理化学及结构(Q3)特性研究技术指导原则(征求意见稿)》。 我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起一个月。 您的反馈意见请发到以下联系人的邮箱: 联系人:李艳杰、刘彦、刘孟斯 联系方式:liyanjie@cde.org.cn、liuyan01@cde.org.cn、liums@cde.org.cn 感谢您的参与和大力支持。 国家药品监督管理局药品审评中心 2026年1月23日 https://www.cde.org.cn/main/news/viewInfoCommon/c533722f282cdd05bcce0e6d6b071316 我中心定于1月30日9:00-11:30举办2026年第一期“药审云课堂”。本期课程将围绕ICH指南监管考虑等相关内容进行解读,由ICH EWG专家深入解读,采用“线上直播+线下参会”双通道模式,设置会前、会中多通道提问入口,拓展交流场景,提升参与体验。现将有关事宜通知如下: (一)课程速览 围绕ICH多项重要指南更新与应用展开,旨在为监管与研发实践提供清晰指导和最新考量: ICH《E23:使用真实世界证据支持监管决策的考虑,重点关注药物有效性》,是继《M14:使用真实世界数据进行药品安全性评估的非干预性研究:规划、设计、分析和报告的一般原则》完成之后新启动的真实世界证据聚焦有效性评价的指南。 ICH Q6A及Q6B是化学物质及生物制品质量标准指导原则,包括检测方法及可接受标准。合理制定质量标准是确保化学药物及生物制品质量可控及批间一致的重要手段。伴随着化学药物及生物技术产品种类的不断扩充,以及生产工艺的迅猛发展,该指导原则在适用范围、检测方法、考察项目及限度设计理念的适用性等方面已无法满足目前实际生产的需要。ICH近期启动了新议题Q6(R1)《质量标准指导原则的修订》的协调,旨在对Q6A及Q6B进行修订。 ICH《S13:基于寡核苷酸疗法的非临床安全性评价》是一项针对寡核苷酸治疗药物(Oligonucleotide-Based Therapeutics,ONTs)非临床安全性评估指南,旨在协调国际监管机构对ONTs的非临床安全性评价的一般考虑和技术要求,促进ONTs的研发。 模型引导的药物研发(Model-Informed Drug Development,MIDD)是创新药研发中的一项重要技术,可应用于药物研发的多个阶段,对于新药研发中的剂量选择、临床试验设计、特殊人群用药以及监管决策等具有重要指导作用。ICH《M15:模型引导的药物研发一般原则》议题旨在就药品注册中的MIDD一般性原则进行协调,目标是制定较高层面的MIDD技术指导原则,具体涵盖MIDD在药物研发中的应用范围和良好实践原则、数据分析方法、申报资料提交标准、风险评估概念、多学科互动框架、申办方和监管机构沟通原则等。 ICH《M18:确定在生物类似药开发项目的比较效果研究实用性的框架》议题旨在建立基于多学科的评估框架以确定在生物类似药的开发中需要开展比较疗效研究(Comparative Efficacy Studies,CES)时的考虑因素,以及当未开展CES研究时如何确保相似的疗效、安全性以及可接受的免疫原性,为生物类似药的开发提供指导,并促进在全球范围内生物类似药监管要求的统一。 (二)答疑互动:培训前期可以登录“药审云课堂平台”——“云课堂提问与互动”对相应主题进行提问,培训过程中在直播互动区进行实时的问题收集,在答疑环节对其中的共性问题进行集中解答。 (一)培训时间:2026年1月30日 上午9:00 – 11:30 (二)面向对象: 此次培训不收取费用,培训面向全社会公开,欢迎药品监管机构、研发企业、药品生产企业的注册及研发相关人员参加。 三、参与方式(任选其一): (一)线上参会:点击药审云课堂平台“药审云课堂直播入口”观看。请扫描下方二维码完成注册。 报名链接: https://zqfpcf.snet.weizan.cn/live/page/655285421?v=1768801429431 (二)线下参会:线下会场设于上海,线下席位限额250名,采用线上报名、先到先得机制。报名成功后将收到参会回执,届时须凭该回执到场完成签到入场。请扫描下方二维码报名。 (三)互动提问:会前可登录“药审云课堂平台”的【云课堂提问与互动】栏目,预先提交与培训主题相关的问题。培训直播期间,亦可通过直播互动区实时提问。 (四)需求反馈:长期欢迎通过“药审云课堂平台”的【云课堂提问与互动】栏目,提出您的培训需求与主题建议。 附件:1. 2026年第一期“药审云课堂”培训日程 2. 在线报名观看流程 https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20260119085720172.html 为推动药品注册技术标准与国际接轨,经研究,国家药品监督管理局决定适用《Q8、Q9和Q10问答(R5)》国际人用药品注册技术协调会指导原则。现将有关事项公告如下: 一、自2026年1月14日起开始的相关研究,均适用《Q8、Q9和Q10问答(R5)》。 二、该问答文件涉及指导原则《Q8(R2):药品研发》、《Q9(R1):质量风险管理》和《Q10:药品质量体系》,相关技术指导原则可在国家药品监督管理局药品审评中心网站查询。国家药品监督管理局药品审评中心负责做好本公告实施过程中的相关技术指导工作。 特此公告。 国家药监局 2026年1月14日 https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/zhybhpzh/zhybhpzhgg/20260120085142173.html 根据《中药品种保护条例》规定,国家药品监督管理局批准西藏藏药集团股份有限公司的十味龙胆花胶囊、株洲千金药业股份有限公司的补血益母丸、赛灵药业科技集团股份有限公司的恒古骨伤愈合剂、重庆香雪医药有限公司的小儿化食口服液、一力制药股份有限公司的虎贞清风胶囊和北京岐黄制药有限公司的双丹明目胶囊为首家中药二级保护品种,保护品种编号分别为:ZYB2072026004、ZYB2072026009、ZYB2072026008、ZYB2072026006、ZYB2072026007、ZYB2072026005。保护期限自公告日起七年。 特此公告。 国家药监局 2026年1月16日 网址: https://www.nmpa.gov.cn/xxgk/ggtg/hzhpggtg/hzhpchjgg/hzhpcjgjj/20260120173328152.html 在2025年国家化妆品抽样检验工作中,经福建省食品药品质量检验研究院等单位检验,产品标签标示名称为LAENNA莱也纳美白隔离防晒乳 SPF50+PA+++等45批次化妆品不符合规定(见附件)。 根据《化妆品监督管理条例》《化妆品生产经营监督管理办法》《化妆品抽样检验管理办法》,国家药品监督管理局已要求上海、湖南、广东、广西等省(区、市)药品监督管理部门对上述不符合规定化妆品涉及的注册人、备案人、受托生产企业等依法立案调查,责令相关企业依法采取风险控制措施并开展自查整改。各省级药品监督管理部门要依法责令相关化妆品经营者停止经营上述化妆品,并依法调查其进货查验记录等情况,对违法产品进行追根溯源,发现违法行为的,依法严肃查处;涉嫌犯罪的,依法移送公安机关。 特此通告。 附件:45批次不符合规定化妆品信息 国家药监局 2026年1月19日 四、2026年1月23日中药品种保护受理公示 网址: https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20260123143707128.html 五、国家药监局关于注销椎间融合器等14个医疗器械注册证书的公告(2026年第13号) 网址: https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20260123165253136.html 按照《医疗器械监督管理条例》有关规定,根据企业申请,国家药品监督管理局注销以下5家企业共14个产品的医疗器械注册证: 一、常州奥斯迈医疗器械有限公司的2个产品:椎间融合器,注册证编号:国械注准20163132419;钛笼椎体内植入物,注册证编号:国械注准20173130107。 二、德国耶拿分析仪器股份公司Analytik Jena AG的1个产品:实时荧光定量PCR分析仪qTOWER3G IVD,注册证编号:国械注进20233220045。 三、(株)五常医疗保健公司OSANG Healthcare Co.,Ltd.的3个产品:血糖仪Blood Glucose Monitoring System,注册证编号:国械注进20182222262;血糖仪Glucolab Auto-coding Blood Glucose Monitoring System,注册证编号:国械注进20182222260;血脂测试片(酶法)Lipid Profile Test Strip,注册证编号:国械注进20172406851。 四、(株)路创丽公司Lutronic Corporation的1个产品:Nd:YAG激光治疗仪Dual Pulsed Nd:YAG Laser,注册证编号:国械注进20173096737。 五、瑞士梅达塔国际有限公司Medacta International SA的7个产品:螺钉Versafitcup System,注册证编号:国械注进20163130722;股骨柄Quadra System,注册证编号:国械注进20153132348;非骨水泥型骨柄Quadra System,注册证编号:国械注进20163135085;髋关节假体-髋臼内衬及球头Hip articular Prostheses,注册证编号:国械注进20163135016;人工膝关节EVOLIS Total Knee Prosthesis,注册证编号:国械注进20163134348;髋关节系统组件Hip System Implants,注册证编号:国械注进20163134106;髋关节组件orthopaedic implants-hip joint prostheses-versaficup,注册证编号:国械注进20153132349。 特此公告。 国家药监局 2026年1月23日 (一)解读《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的实施意见》 网址: http://www.shandong.gov.cn/vipchat1//home/site/82/4742/article.html 时间: 2026年1月16日(星期五)上午10:00 出席: 省药监局党组书记、局长,新闻发言人李涛 省科技厅二级巡视员李百东 省卫生健康委副主任徐民 省医保局副局长、新闻发言人李博 省药监局副局长林炳勇 内容: 邀请省药监局主要负责同志等解读《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的实施意见》 二、上海市药品监督管理局 (一)上海市药品监督管理局关于上海市中药配方颗粒试行标准(第一批)的公示 网址: https://yjj.sh.gov.cn/zx-yp/20260120/d1bc8e929ee14005b3df5413ff0dec89.html 按照《上海市药品监督管理局关于发布外省中药配方颗粒质量标准转化为本市试行标准工作程序的通告》的规定,市药品检验研究院对申请转化为本市中药配方颗粒试行标准的申报资料进行了技术审核,形成了第一批8个上海市中药配方颗粒试行标准(公示稿),现就上述中药配方颗粒试行标准进行公示(详见附件),公示期自发布之日起30天。 公示期间,相关单位如有异议,请及时来函将意见反馈至上海市药品监督管理局药品注册处。公示期满未回复意见即视为对公示标准无异议。 联系人:常云成,毛秀红 电话:021-54909078;021-38839900-26602 电子邮件:ypzc@smda.sh.cn 地址:上海市徐汇区宜山路728号 邮编:200233 附件: 上海市药品监督管理局 2026年1月20日 三、北京市药品监督管理局 (一)新增2个共性问题 网址: https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/bjah-index-dept!detail.action?originalId=AH26012201169 四、广东省药品监督管理局 (一)广东省药品监督管理局2025年法治政府建设年度报告 网址: http://mpa.gd.gov.cn/zwgk/gzwj/content/post_4846990.html 2025年,广东省药品监督管理局坚持以习近平新时代中国特色社会主义思想为指导,全面贯彻落实党的二十大和二十届历次全会精神,深入践行习近平法治思想,认真落实法治建设“一规划两纲要”,坚决落实省委“1310”具体部署,按照省政府工作要求,不断完善药品监管法治体系,统筹推进法治政府建设取得新成效。 一、强化思想引领,高位推动药品监管法治建设 (一)深入学习贯彻习近平新时代中国特色社会主义思想。深入学习贯彻习近平总书记关于党的建设的重要思想、关于党的自我革命的重要思想,坚持以党的政治建设为统领,加强基层组织建设,深化正风肃纪反腐,强化全面从严治党主体责任落实,为药品监管高质量发展提供坚强保障。认真学习贯彻习近平总书记“7·29”重要指示精神,深入学习贯彻党的二十大和二十届历次全会精神。 (二)抓实走深习近平法治思想学习贯彻。始终把学深悟透习近平法治思想作为全面推进药品监管法治建设的重要抓手,把学习宣传贯彻习近平法治思想以及贯彻习近平总书记关于宪法的重要讲话重要指示批示精神,纳入局党组理论学习中心组学习重要内容安排。通过局党组理论学习中心组扩大学习、机关全体干部学法讲座、全省药品监管法律骨干培训班等形式,邀请来自国家药监局、司法部门、高校专家授课,进一步深入学习宪法精神和习近平法治思想等内容,切实加强党员干部队伍法治思维和法治理念的培养。 (三)切实履行推进法治建设第一责任人职责。省药品监管局高度重视药品监管法治工作,紧抓“关键少数”,严格履行推进法治建设第一责任人职责,多次召开局党组会、局务会议、依法行政重点工作推进会等。严格落实“第一议题”和党组理论学习中心组学习制度,局领导班子带头学习,及时传达学习习近平总书记重要指示重要讲话精神,学习省委法治建设有关文件精神。局党组主动落实主体责任,定期研究党建重大问题、推进党建重点工作。研究部署年度法治政府建设工作要点,定期分析解决法治政府建设难题。认真做好法治政府建设年度报告工作,依法开展重大案件集体审议,自觉做尊法学法守法用法的模范。 二、完善制度保障,夯实药品监管法治基础 (一)完善药品监管法治体系。结合广东实际,制修订《药品监督管理行政处罚裁量适用规则实施细则》及其裁量基准、《广东省粤港澳大湾区内地九市临床急需进口港澳药品医疗器械目录管理办法》等规范性文件,形成“上位法+地方配套+实操细则”的多层次监督管理体系。建成“ISO 9000质量管理系统(QMS)文件”管理系统及其粤政易移动端口“粤药法库”,持续收集整理药品监管法律法规和重要文件制度。 (二)完善依法行政制度保障。定期召开依法行政重点工作推进会,推进法治政府建设、规范涉企行政检查等依法行政重点工作落地落实。认真组织开展规范涉企行政执法专项行动,乱收费、乱罚款、乱检查、乱查封等问题得到有效整治。联合省公安厅、省生态环境厅、省卫生健康委等部门做好药品领域跨部门综合监管检查工作,进一步优化“综合查一次”,持续整合内部监管资源,强化融合监管。积极与省司法厅沟通协调,加快推进事业单位在编人员执法证申领工作。 (三)扎实有效开展普法宣传教育。组织专题学习宪法、《中华人民共和国法治宣传教育法》等法律法规,举办年度全省药品监管法律骨干培训班,召开药品法律热点难点研讨会,聚焦药品监管法律业务,进一步提高法制人员依法行政能力。举办“全国药品安全宣传”系列活动,首次在全省范围内开展安全用药进社区“百千万”大行动,多次组织药品安全科普普法进基层活动。组织干部参加学法考试,参与率和优秀率均为100%。“粤药法通”项目获评2024-2025年全省国家机关“谁执法谁普法”优秀普法工作项目。普法视频《如您所愿》荣获第十九届全国法治动漫微视频作品征集展播活动百部优秀作品。 (四)依法开展法治监督工作。严把规范性文件合法性审查关,完成《药品监督管理行政处罚裁量适用规则实施细则》等规范性文件审查,按要求开展政策措施和规范性文件的公平竞争审查工作。圆满完成建议提案的答复工作,以建议提案办理为抓手推动各项工作开展,办理质效明显提升。妥善办理复议诉讼案件的答辩工作,不断在法治轨道上推动矛盾纠纷实质化解。 三、筑牢监管防线,促进严格规范公正文明执法 (一)严格规范公正文明执法。持续紧盯重点违法违规行为聚焦用力,持续开展专项打击行动查办大案要案,不断完善行刑衔接与跨区域跨层级跨部门联合执法,全方位筑牢药品安全底线。在严格落实“四个最严”的同时,省药品监管局行政执法体现监管温度,帮助某企业解决棘手的产品合规性历史遗留问题,有力维护广东药企的整体声誉。 (二)强化药品监管能力建设。省药检所为全国首家放射性药品检验授权省级机构,率先建成新国标Ⅰ级生物制品(疫苗)批签发实验室。省医械所为国内首个获得IECEE CB检测实验室资质的省级医疗器械检验机构,资质涵盖电磁兼容和医用电气设备领域12项IEC标准。在全国率先推出AI免费辅助工具“粤安评”,有效提升化妆品完整版安评报告提交率,大大降低企业成本。开发化妆品辅助备案审查工具“粤妆评”,提高备案审核效率和质量。启动“人工智能+药品监管”三年行动,加快推进监管新工具、新标准、新方法开发运用。 (三)加强行政职权事项管理。根据法律法规变化和职能职责调整,梳理形成广东省药品监管省级政务服务事项实施清单(内部版),并组织开展药品监管省级政务服务事项动态调整,完善行政许可、行政检查、行政处罚等清单。落实证照分离改革成果,按照省政府有关要求和时限顺利完成委托事项交接。梳理省药品监管局省级行政职权事项委托调整下放情况,完成省级事项调整下放的摸底工作,持续推进省级事项下放地市工作。 (四)全面推进政务公开。依法公开药品监管领域信息,公开药品安全监督抽查等信息。规范政府信息依申请公开办理,本年度收到的政府信息公开申请均已按时办结。各投诉举报事项均在期限内分派交办到相关办理单位,及时跟踪督办,确保投诉举报事项及时处理。制定2025年度重大行政决策事项目录,并及时在局门户网站公布。 四、紧扣发展大局,依法全面履行药品监管职能 坚持依法行政,积极探索药品监管改革,推动药品产业高质量发展。一是全力落实省政府生物医药产业高质量发展行动方案,开展药械审评重心前置、研审联动、滚动审评、AI辅助,审评能力居全国前列。二是持续提升审评审批效能。助力全国首个基孔肯雅病毒检测试剂在3个月内获批上市,创造了疫情应急产品注册上市的“广东速度”。三是纵深推进粤港澳大湾区药械监管创新。2025年,“港澳药械通”指定医疗机构达71家,实现大湾区内地9市全覆盖,引进港澳已上市药械品种149种,惠及粤港澳大湾区居民近2万人次。四是贯通联动国家重大药械审评审批改革,首批获准开展优化药品补充申请审评审批程序改革试点,补充申请审评审批大幅提速。 2026年,省药品监管局将继续坚持把学懂弄通做实习近平新时代中国特色社会主义思想作为首要政治任务,深入践行习近平法治思想,加强党对法治政府建设的领导,持续提升法治政府建设的能力,在法治轨道上筑牢药品安全底线,大力推动医药产业高质量发展。一是继续完善法治体系建设。不断健全完善药品监管制度,定期梳理疑难突出问题,加强法治思维和法律原则与药品监管依法行政研究、药品监管法律法规适用疑难问题及其对策研究成果转化,着力推进依法行政工作。深入开展制度研究,积极参与大湾区建设。二是有效加强法治宣传教育。不断创新普法形式、增强普法效果,深入谋划药品安全第九个法治宣传教育规划,集中在全国药品安全宣传周、宪法宣传周等活动中积极传递药监声音,努力营造良好的药品监管法治氛围。三是聚焦提升执法办案效能。持续推进跨部门综合监管、规范涉企行政检查等各项重点工作任务落实。加强药品行政执法与刑事司法衔接,加大重大案件查办力度。加强重点领域安全监管,进一步加强重点品种、重点环节和重点区域监管。四是加强法治人才的培养。进一步加强监管队伍建设,加强药品监管干部培训,提高全体人员的法治素养,充分发挥职业化专业化药品检查员的力量。进一步增强依法行政能力,为药品安全监管及产业高质量发展提供有力支撑。



品种名称:ONC201胶囊



一、培训内容
二、培训安排